
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| tmin | Xmol | Ymol | Zmol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
 2Z
2Z 2Z
2Z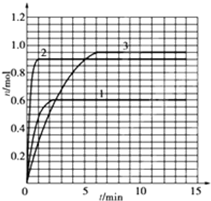
查看答案和解析>>
科目:高中化学 来源: 题型:
 23.25℃时,向25mL0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1 H2B溶液,曲线如图所示,a>12.5.回答下列问题:
23.25℃时,向25mL0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1 H2B溶液,曲线如图所示,a>12.5.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
| O | 2- 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com