
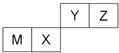
| A. | 离子半径Y<Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的强 | |
| C. | X的最简单气态氢化物的热稳定性比Z的大 | |
| D. | 单质沸点:M>X>Y |
分析 四种短周期元素只有M为金属元素,由元素在周期表中的位置,可知M为Al、X为Si、Y为N、Z为O;
A.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
B.非金属性越强,最高价氧化物对应水化物的酸性越强;
C.非金属性越强,氢化物越稳定;
D.X为Si,属于原子晶体,熔点最高,常温下Al为固体,在空气中加热时发生熔化,熔点低于晶体硅,而Y的单质为气体.
解答 解:四种短周期元素只有M为金属元素,由元素在周期表中的位置,可知M为Al、X为Si、Y为N、Z为O.
A.N3-、O2-、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径:N3->O2->Al3+,故A错误;
B.非金属性N>Si,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性:硝酸>硅酸,故B正确;
C.氢化物稳定性与元素非金属性一致,Z的非金属性比X的强,故Z的氢化物更稳定,故C错误;
D.X为Si,属于原子晶体,熔点最高,常温下Al为固体,在空气中加热时发生熔化,熔点低于晶体硅,而Y的单质为气体,Al的熔点高于氮气,故熔点:X>M>Y,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,注意对元素周期律的整体把握,掌握物质熔沸点高低比较.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:解答题
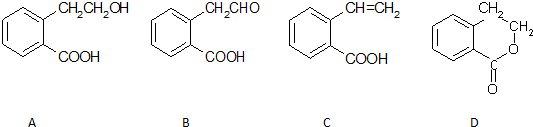
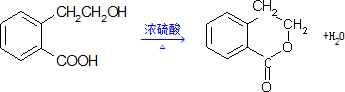 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量开发利用深海可燃冰,有助于海洋生态环境的治理 | |
| B. | 汽车尾气中含有大量大气污染物,其原因是汽油不完全燃烧造成的 | |
| C. | 煤炭燃烧过程安装固硫装置,目的是提高煤的利用率 | |
| D. | PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始加入合金的总物质的量为0.15mol | |
| B. | 生成NO气体体积在标准状况下为2.24L | |
| C. | 生成沉淀完全时消耗NaOH溶液体积为100mL | |
| D. | 原硝酸物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体甲可能为纯净物 | |
| B. | 该溶液中一定存在NH4+、Al3+、NO2-、SO42- | |
| C. | 该溶液中一定不存在Na+、Mg2+、HCO3-、Cl- | |
| D. | 无法确定Na+、HCO3-、NO2-是否存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
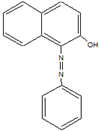 2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )
2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )| A. | 它属于芳香烃 | B. | 它的分子式为C16H13ON2 | ||
| C. | 它能发生取代反应和加成反应 | D. | 它与苯互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com