
| A. | 太阳能、氢能、风能、地热能、海洋能和生物质能等属于新能源 | |
| B. | 根据能量守恒定律,生成物总能量一定等于反应物总能量 | |
| C. | 放热反应在常温下一定很容易发生 | |
| D. | 吸热反应在常温下一定不能发生 |
分析 A.煤、石油、天然气是化石燃料,太阳能、核能、地热能、海洋能、风能、氢能、生物质能等都是新能源;
B.化学反应过程中一定伴随能量的变化,反应物总能量与生成物总能量一定不相等,反应放热还是吸热决定于反应物和生成物能量高低;
C.放热反应在常温下不一定很容易发生,如物质的燃烧以及铝热反应等;
D.当反应物所具有的总能量低于生成物所具有的总能量的反应为吸热反应,与是否常温无关.
解答 解:A.煤、石油、天然气是化石燃料,太阳能、核能、地热能、海洋能、风能、氢能、生物质能等都是可再生、无污染的新能源,故A正确;
B.化学反应过程中一定伴随能量的变化,反应物总能量与生成物总能量一定不相等,反应中伴有声能、光能等,当反应物的能量高于生成物总能量时,反应是放热反应,反之吸热,故B错误;
C.化学反应一定伴随着能量的变化,当反应物所具有的总能量高于生成物所具有的总能量的反应为放热反应,反之为吸热反应,反应能否在常温下进行,与是否放热无关,如铝热反应为放热反应,但在高温下进行,故C错误;
D.氢氧化钡晶体与氯化铵的反应在常温下就可进行,为吸热反应,故D错误;
故选A.
点评 本题考查了化学反应能量变化的实质理解应用,为高频考点,侧重于学生的分析能力的考查,注意反应过程中能量守恒的分析应用,题目较简单.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
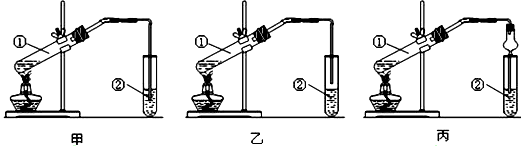
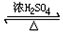 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②⑤⑥ | C. | ③④⑤⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25% | B. | 40% | C. | 60% | D. | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
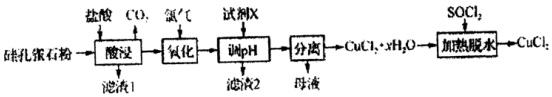
 在2L的密闭绝热容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列叙述不正确的是( )
在2L的密闭绝热容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列叙述不正确的是( )| A. | 反应开始到10s时,转化率:Y>X | |
| B. | 若前10s容器内的压强增加,说明生成Z的反应为放热反应 | |
| C. | 由图象可知前10s内生成Z的速率越来越快 | |
| D. | 若X为紫色,Y、Z无色,则10s后混合气体颜色不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取反应后溶液,滴入几滴KSCN溶液,无血红色出现 | |
| B. | 该合金中铁与铜的物质的量之比是1:2 | |
| C. | 反应后溶液(忽略溶液体积变化)中c(H+)=2.5 mol•L-1 | |
| D. | 向反应后的溶液中加入2.0 mol•L-1NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是120 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
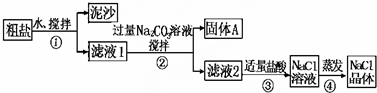
| 猜想 | 验证的操作 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含有BaCO3 | 取少量固体A于试管中,先滴入过量稀硝酸(或稀盐酸),再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | 猜想Ⅱ不成立 |
| 猜想Ⅱ:最后制得的NaCl晶体中还有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, 先滴入BaCl2溶液,再滴入过量稀HNO3 | 有白色沉淀 | 猜想Ⅱ成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com