

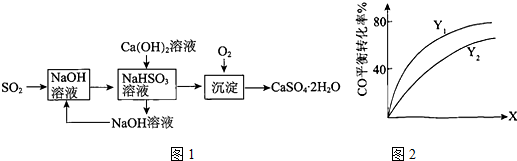
���� I����1��Aװ���з�Ӧ���ɶ�����̼��Bװ�ò�������������C������������Һ��Ӧ��Ϊ���������������NO����NO2�����ö�����̼�ž�װ���п���������E�г���ʯ��ˮ������ж�װ���п����ž�������D��������ɫ�����ж������
��2����ע������Ŀ���ע�뼯��ƿD�У�������ɫ�����Ϊ����ɫ��˵������NO��������������Ϊ�������
��3���������������������ж���������Ⱦ��������Ҫ����β��������
��1��A�¶��£�������������Ϊ50g-25g=25g��50gNa2SO3•7H2O�нᾧˮ������Ϊ50g��$\frac{18��7}{126+18��7}$=25g������¶��·ֽ���ȫʧȥ�ᾧˮ��
����B����Һ��pH����A����Һ��pH����������ᡢ������ĵ���ƽ�ⳣ���������ж�B��ֽ��������������ƣ�����������ԭ��Ӧ���������������ɣ�
��2�����������ᷴӦ���ɳ�������ζ����������ƣ����������ᱵ��Һ���������ƣ�
��� �⣺I����1��Aװ���з�Ӧ���ɶ�����̼��Bװ�ò�������������C������������Һ��Ӧ��Ϊ���������������NO����NO2�����ö�����̼�ž�װ���п���������E�г���ʯ��ˮ������ж�װ���п����ž�������D��������ɫ�����ж������
�ʴ�Ϊ���ž�����װ���ڵĿ�������ֹ��ʵ��������ţ�E�г���ʯ��ˮ���ֻ��ǣ���
��2����ע������Ŀ���ע�뼯��ƿD�У�������ɫ�����Ϊ����ɫ��˵������NO��������������Ϊ���������Ӧ����ʽΪ��3SO2+2NaNO3+2H2O=Na2SO4+2NO+2H2SO4��
�ʴ�Ϊ��3SO2+2NaNO3+2H2O=Na2SO4+2NO+2H2SO4��
��3���������������������ж���������Ⱦ��������Ҫ����β��������
�ʴ�Ϊ��û��β������װ�ã�
��1��A�¶��£�������������Ϊ50g-25g=25g��50gNa2SO3•7H2O�нᾧˮ������Ϊ50g��$\frac{18��7}{126+18��7}$=25g������¶��·ֽ���ȫʧȥ�ᾧˮ����Ӧ����ʽΪ��Na2SO3•7H2O$\frac{\underline{\;\;��\;\;}}{\;}$Na2SO3+7H2O��
����B����Һ��pH����A����Һ��pH����������ᡢ������ĵ���ƽ�ⳣ���������ж�B��ֽ��������������ƣ�����������ԭ��Ӧ���������������ɣ���Ӧ����ʽΪ��4Na2SO3$\frac{\underline{\;��600��\;}}{\;}$3Na2SO4+Na2S��
�ʴ�Ϊ��Na2SO3•7H2O$\frac{\underline{\;\;��\;\;}}{\;}$Na2SO3+7H2O��4Na2SO3$\frac{\underline{\;��600��\;}}{\;}$3Na2SO4+Na2S��
��2������B�¶��²���ijɷ�ʵ�鷽��Ϊ��ȡB�¶��µĹ��������������ˮ�ܽ⣬����Һ�м��������������г�������ζ������������ټ��Ȼ�����Һ�а�ɫ�������ɣ���֤������ΪNa2SO4��Na2S��
�ʴ�Ϊ��ȡB�¶��µĹ��������������ˮ�ܽ⣬����Һ�м��������������г�������ζ������������ټ��Ȼ�����Һ�а�ɫ�������ɣ���֤������ΪNa2SO4��Na2S��
���� ���⿼����������̽��ʵ�顢������ɵIJⶨ����ѧ����ȣ��Ƕ�ѧ���ۺ������Ŀ��飬�ؼ���ԭ�������⣬�ϺõĿ���ѧ�����������ѧ�����������


 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ | |
| B�� | ��ʹ��ɫʯ����Һ��� | |
| C�� | �ܱ����ˮ�к� | |
| D�� | �����£�0.1 mol•L-1������Һ�е�c��H+��Ϊ1.32��10-3mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ${\;}_{1}^{2}$H | 2He | 2Cl | Ca2+ | |
| A | ������ | ������ | ������ | ����� |
| B | ������ | ������ | ԭ�Ӹ��� | ����� |
| C | ������ | ������ | ԭ�Ӹ��� | ������ |
| D | ������ | ������ | ������ | ����� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3CH2COOCH=CH2 | B�� | CH3CH2COOCH2CH2CH3 | ||
| C�� | CH2=CHCH2COOCH2CH2CH=CH2 | D�� | CH3CH2CH2COOCH2CH��CH3��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڳ�ʪ�Ļ����£���ͭ��пͭ�Ͻ𣩱ȴ�ͭ����ʴ | |
| B�� | �������϶�ͭʱ�������������Ȼ�ͭ��Һ���������Һ | |
| C�� | ��ϡ�������������Һ��пͭ�ֱ����缫���ɵ�ԭ����У�п�������������� | |
| D�� | ��ҵ����ʯī���缫������ڵ�AlCl3��ȡAlʱ��ÿ����1mol Al�������Ͳ���33.6L���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C��NO��10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C��CO��10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| ������ | T/�� | NO��ʼŨ��/10-3mol•L-1 | CO��ʼŨ��/10-3mol•L-1 | �����ıȱ����/m2•g1 |
| �� | 350 | 1.20 | 5.80 | 124 |
| �� | 280 | 1.20 | 5.80 | 124 |
| �� | 280 | 1.20 | 5.80 | 82 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
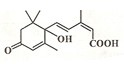 �������˻��ڼ�Դ��������ʻ�ʩ����S-�տ����Ƽ����Ա����ʻ�ʢ����S-�տ��صķ��ӽṹ��ͼ�����й��ڸ÷���˵����ȷ���ǣ�������
�������˻��ڼ�Դ��������ʻ�ʩ����S-�տ����Ƽ����Ա����ʻ�ʢ����S-�տ��صķ��ӽṹ��ͼ�����й��ڸ÷���˵����ȷ���ǣ�������| A�� | ����̼̼˫�����ǻ����ʻ����Ȼ� | B�� | 1mol�����ʿ�����2molNaOH | ||
| C�� | ����ʽΪC14H20O4 | D�� | 1mol�����ʿ���3molH2�ӳ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��ˮ����ɫ��dz����ɫ��˵����ˮ�к���Cl2 | |
| B�� | ����ˮ�еμ������ữ��AgNO3��Һ��������ɫ������˵����ˮ�к���Cl- | |
| C�� | ����ˮ�м���NaHCO3��ĩ�������ݲ�����˵����ˮ�к���HClO | |
| D�� | ��FeCl2��Һ�еμ���ˮ����Һ��ɫ����ػ�ɫ��˵����ˮ�к���HClO |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com