
【题目】下面是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验。请回答下列问题:
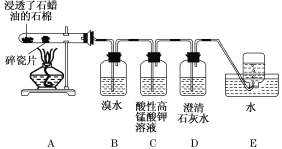
(1)A中碎瓷片的作用是 。
(2)B装置中反应的化学方程式为: 。
(3)C装置中可观察到的现象是__________________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置________(填字母)中的实验现象可判断该资料是否真实。
(5)通过上述实验探究,检验甲烷和乙烯的方法是________(选填字母,下同);除去甲烷中乙烯的方法是__________。
A.气体通入水中
B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
(6)下列物质中,不是通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
【答案】(1)催化作用;(2)CH2===CH2+Br2―→BrCH2—CH2Br;(3)紫(红)色褪去;(4)D;(5)BC,B;(6)B。
【解析】
试题分析:(1)碎瓷片的作用是催化剂;(2)乙烯和溴水发生加成反应,CH2=CH2+Br2→BrCH2CH2Br;(3)乙烯能够被酸性高锰酸钾溶液氧化,因此现象是紫红色褪去;(4)CO2能使澄清石灰水变浑浊,如果D装置变浑浊,说明改资料的事实;(5)检验甲烷和乙烯,利用乙烯能使溴水褪色或酸性高锰酸钾溶液褪色,而甲烷不行,因此选项BC正确,除去甲烷中的乙烯,不能引入新杂质,不能用酸性高锰酸钾溶液,因为产生CO2,因此采用溴水,选项B正确;(6)A、是乙烯和氢气发生加成反应产生的,故错误;B、是通过乙烷和氯气发生取代反应产生,故正确;C、乙烯和水发生加成反应产生,故错误;D、乙烯和HBr发生加成产生,故错误。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列递变规律正确的是
A. C、N、O最高正价依次升高
B. 钠、镁、铝的还原性依次减弱
C. HC1、HBr、HI的稳定性依次增强
D. H3PO4、H2SO4、HC1O的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
B | B原子得到一个电子后3p轨道全充满 |
C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物水化物的酸性为同主族最强 |
E | E元素的核电荷数等于A原子的核电荷数和B元素氢化物的核电荷数之和 |
(1)元素Y是C下一周期同主族元素,比较B、Y元素的第一电离能I1(B) I1(Y)(填“>”“=”或“<”);
(2)盐X的水溶液呈 (填“酸性”“碱性”或“中性”) ,原因________________(用离子方程式表示);
(3)E元素原子的核外电子排布式为_____________,在周期表中的位置______________;
(4)C单质分子中σ键和π键的个数比为 ,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是____________________________________________;
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: ,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-).下列说法正确的是
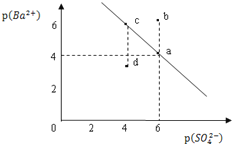
A. 该温度下,Ksp(BaSO4)=1.0×10-24
B. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
C. d点表示的是该温度下BaSO4的不饱和溶液
D. 加入BaCl2可以使溶液由c点变到a点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50ml物质的量浓度均为0.1mol/L (NH4)2SO4、Al2(SO4)3溶液中逐滴滴入0.1mol/L Ba(OH)2溶液200ml,随着Ba(OH)2溶液体积的变化,沉淀总物质的量(n)的变化如图所示。下列叙述不正确的是

A.a=150
B.Y点对应溶液为氨水
C.OX、XY两段沉淀种类相同
D.继续滴加Ba(OH)2溶液,发生的离子反应为Al(OH)3+OH-=AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿制高锰酸钾的流程如下:
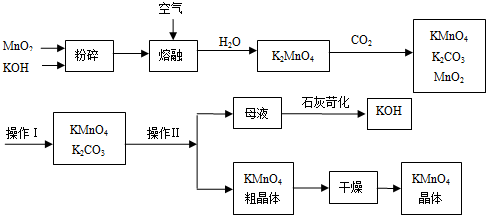
请回答下列问题:
(1)该生产中需要纯净的CO2气体.写出实验室制取CO2的化学方程式 。
(2)KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列物质相同的是 (填字母).
a.75%酒精 b.双氧水 c.苯酚 d. 84消毒液(NaClO溶液)
(3)写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式: 。
(4)上述流程中可以循环使用的物质有 、 (写化学式).
(5)测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不恢复,表明达到滴定终点。写出该反应的离子方程式: 。
(6)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13。工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)= ___________________。
(7)操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在溶解性上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx都是大气污染物。
(1)汽车排放的尾气中含CO和NO,汽车发动机工作时产生的NO和CO可通过催化转化器转化为两种无污染的气体,该反应的化学方程式是_________________________________________;
(2)采取还原法,用炭粉可将氮氧化物还原.
已知:N2(g)+O2(g)=2NO(g)△H=+180.6kJmol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1
则反应C(s)+2NO(g)=CO2(g)+N2(g)△H=__________kJmol-1.
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为_____________(填写“氧化剂”
或“还原剂”).下式中X必须为无污染的物质,系数n可以为0;
NO2+G![]() N2+H2O+nX (未配平的反应式);
N2+H2O+nX (未配平的反应式);
下列化合物中,满足上述反应式中的G是________(填写字母);
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
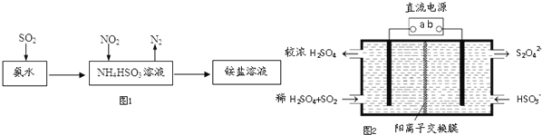
(4)利用氨水可以将SO2和NO2吸收,原理如图1所示:NO2被吸收的离子方程式是______________;
(5)利用图2所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2.
①b极的电极反应式为__________________________;
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成.该反应离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列物质:①16O和18O ②红磷和白磷 ③CH3CH3和CH3CH2CH2CH3 ④CH3CH2CH2CH3 和CH3CH (CH3) 2 ⑤O2和O3 ⑥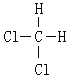 和
和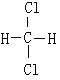
(1)属于同素异形体的是(填序号,下同) ,
(2)属于同系物的是 。
II.如图所示为CH4燃料电池的装置(A、B为多孔碳棒):
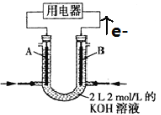
(1) (填A或B)处电极入口通甲烷,其电极反应式为 ;
(2)当消耗甲烷的体积为11.2 L(标准状况下)时,消耗KOH的质量为 g。
Ⅲ.铅蓄电池是最早使用的充电电池,由Pb、PbO2、稀硫酸构成。该电池工作时,若电路中转移2 mol电子,则负极材料质量的变化量为 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com