
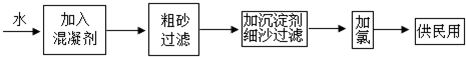
分析 (1)常用混凝剂为FeSO4•7H2O,被氧化、水解后生成Fe(OH)3,具有吸附作用,可除去水中的悬浮物;
(2)除去Ca2+、Mg2+,应先加入石灰,然后加入纯碱,可除去过量的钙离子;
(3)由氯气与水反应的平衡常数K=4.5×10-6可知,该反应的限度很小,生成的HClO浓度很小,而反应是可逆反应,次氯酸消耗平衡正向移动,所以可以有效地控制次氯酸的浓度;臭氧和K2FeO4有强氧化性,可用作饮用水的消毒剂.
解答 解:(1)常用混凝剂为FeSO4•7H2O,被氧化、水解后生成Fe(OH)3,具有吸附作用,可除去水中的悬浮物,所以混凝剂除去杂质的过程中既有化学变化也有物理变化,亚铁离子被氧化的离子反应为:4Fe2++O2+10H2O=4Fe(OH)3+8H+,故答案为:③;Fe(OH)3;4Fe2++O2+10H2O=4Fe(OH)3+8H+;
(2)除去Ca2+、Mg2+,应先加入石灰,然后加入纯碱,过量的钙离子可通过纯碱使之沉淀下来,故答案为:生石灰;纯碱;过量的钙离子可通过纯碱使之沉淀下来;
(3)由氯气与水反应的平衡常数K=4.5×10-6可知,该反应的限度很小,生成的HClO浓度很小,而反应是可逆反应,次氯酸消耗平衡正向移动,所以可以有效地控制次氯酸的浓度,臭氧和K2FeO4有强氧化性,可用作饮用水的消毒剂,故答案为:由氯气与水反应的平衡常数可知,该反应的限度很小,生成的HClO浓度很小,且随着HClO的消耗,平衡会不断向正反应移动,补充HClO;①③.
点评 本题考查物质的分离和提纯,题目难度不大,注意常用混凝剂为FeSO4•7H2O,被氧化、水解后生成Fe(OH)3.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时要吸收大量的热,常用作制冷剂 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料 | |
| D. | 铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝比铁更耐酸碱的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
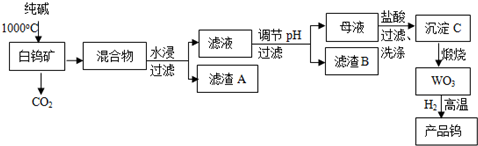
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
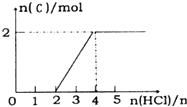 A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题: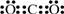 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 五种 | B. | 四种 | C. | 三种 | D. | 二种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

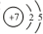 ,其单质的电子式为
,其单质的电子式为 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由碳燃烧生成CO的热化学方程式是C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=(Q1-0.5Q2)kJ/mol | |
| B. | 由碳燃烧生成1mol CO放出的热量是(Q1-0.5Q2)kJ | |
| C. | 由碳燃烧生成CO的热化学方程式是2C(s)+O2(g)═2CO(g)△H=(Q2-2Q1)kJ/mol | |
| D. | 碳和CO2反应的热化学方程式是C(s)+CO2(g)═2CO(g)△H=(2Q2-2Q1)kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com