
| A. | Al2O3、Fe2O3均为两性氧化物 | |
| B. | 该反应中化学能全部转化为热能 | |
| C. | Al2O3中的微粒半径:r(Al3+)>r(O2-) | |
| D. | 在该反应条件下,Al的还原性强于Fe的还原性 |
分析 A.氧化铁是碱性氧化物,氧化铝是两性氧化物;
B.反应过程中主要是化学能转化为热能,同时还有光能等;
C.电子排布相同的微粒,原子序数越大,微粒半径越小;
D.氧化还原反应中还原剂的还原性大于还原产物的还原性.
解答 解:A.氧化铝为两性氧化物,氧化铁是碱性氧化物,故A错误;
B.铝热反应过程中放热同时发光,化学能转化为热能、光能等,故B错误;
C.电子排布相同的微粒,原子序数越大,微粒半径越小,则微粒半径:r(O2-)>r(Al3+),故C错误;
D.氧化还原反应中还原剂的还原性大于还原产物的还原性,2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,反应中Al作还原剂,所以铝的还原性强于铁的还原性,故D正确;
故选D.
点评 本题考查氧化还原反应、微粒半径比较,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应中基本概念,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol O2作为氧化剂得到的电子数为2NA | |
| B. | 在0℃,101kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 | |
| D. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 | |
| B. | 过程②中结晶出的MgCl2•6H2O要在HCl氛围中加热脱水制得无水MgCl2 | |
| C. | 过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入化学药品的顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| D. | 在过程③⑤中溴元素均被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
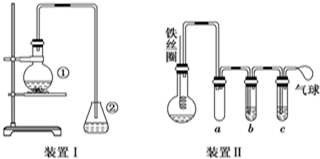
 .
. 与Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的产物,可用NaOH溶液(或水)试剂洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 表述1 | 表述2 | |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中Cl-与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比GeH4分子稳定性高 | Ge的原子半径比C的大,Ge与H之间的键能比C与H间的小 |
| C | 向溴乙烷中加入NaOH水溶液,加热反应,再加入AgNO3溶液有浅黄沉淀 | 证明溴乙烷中含有溴原子 |
| D | P4O10、C6H12O6溶于水后均不导电 | P4O10、C6H12O6均属于共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{115{w}_{2}-84{w}_{1}}{31{w}_{1}}$ | B. | $\frac{84({w}_{1}-{w}_{2})}{31{w}_{1}}$ | ||
| C. | $\frac{73{w}_{2}-42{w}_{1}}{31{w}_{1}}$ | D. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com