
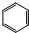
 ,甲苯结构简式为
,甲苯结构简式为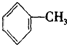 ,故答案为:
,故答案为: ;
; ;
;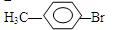 、
、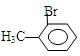 ,甲苯在光照条件下与溴蒸气反应取代反应,Br取代甲基上的H,化学方程式为:
,甲苯在光照条件下与溴蒸气反应取代反应,Br取代甲基上的H,化学方程式为: ,
, 、
、 ;
; ;
; ,
, ;
;

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
| A、溶液的颜色变得更绿 |
| B、溶液中出现白色沉淀 |
| C、溶液颜色由绿变黄 |
| D、上述现象均不可能出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60mL | B、45mL |
| C、30mL | D、75mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | ||
| 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-)≤10-5mol?L-1 |
| c(OH-)≥10-4mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类标准 | 电解质 | 盐 | 非电解质 | 混合物 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com