
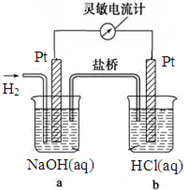
 如图向a中通入H2,发现灵敏电流计指针发生偏转,持续通入H2可观察到b中铂电极表面有少量气泡产生,负极反应式为H2-2e-+2OH-=2H2O,电池的总反应为HCl+NaOH=H2O+NaCl.
如图向a中通入H2,发现灵敏电流计指针发生偏转,持续通入H2可观察到b中铂电极表面有少量气泡产生,负极反应式为H2-2e-+2OH-=2H2O,电池的总反应为HCl+NaOH=H2O+NaCl. 分析 形成原电池反应,负极反应为H2-2e-+2OH-=2H2O,观察到b中铂电极表面有少量气泡产生,应为原电池的正极反应,电极方程式为2H++2e-=H2↑,以此解答该题.
解答 解:形成原电池反应,负极反应为H2-2e-+2OH-=2H2O,观察到b中铂电极表面有少量气泡产生,应为原电池的正极反应,电极方程式为2H++2e-=H2↑,正负极相加为OH-+H+=H2O,即总反应式为HCl+NaOH=H2O+NaCl,
故答案为:H2-2e-+2OH-=2H2O;HCl+NaOH=H2O+NaCl.
点评 本题考查了原电池的工作原理及设计原电池,为高频考点,侧重于学生的分析能力的考查,注意把握题给信息以及电极方程式的书写,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液的溶质不可能是NaHSO4 | |
| B. | 向该溶液中加入铝粉,一定能产生大量H2 | |
| C. | 下列离子在该溶液中一定能大量共存:Cl-、K+、Cu2+ | |
| D. | 向该溶液中加入NaHCO3固体,一定有化学反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
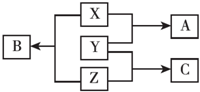 X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题:
X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; 2NH3;
2NH3;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
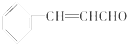
| A. | 煮沸肉桂醛与新制Cu(OH)2的混合物有砖红色沉淀生成 | |
| B. | 电解肉桂醇制得的肉桂醛在电解池的阳极生成 | |
| C. | 仅用新制银氨溶液和溴水不能鉴别肉桂醛中的碳碳双键 | |
| D. | 13.2g肉桂醛分子中含有碳碳双键数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:
硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁.硫酸亚铁铵在 500℃时隔绝空气加热完全分解.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com