
实验室用装置Ⅰ制氨气和氧气的混合气体,A中装有浓氨水,C中盛有碱石灰;用装置Ⅱ
验证氨的某些性质,D内放置催化剂(铂石棉),按气流方向①→②→③→④连接各仪器。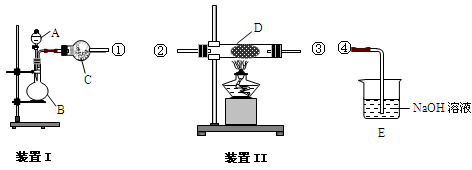
请回答下列问题:
(1)①仪器A的名称是 ,仪器B中应加入的固体药品 (填化学式);
②实验中观察到D内红棕色气体的化学式为 ,证明氨气具有 性;
(2)若用装置Ⅰ制取干燥的SO2气体,则:
①B中发生反应的化学反应方程式为 ;
②此时仪器C中改为盛装P2O5 的作用是 。
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:实验题
(18分)I.实验室制备、收集干燥的SO2,所需仪器如下。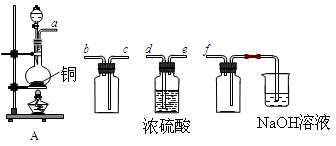
(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为a→ ____→ ____ →____→____f。
(2)装置A中发生反应的化学方程式为____________________________________。
(3)验证产生的气体是SO2的方法是________________________________________。
II.SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示: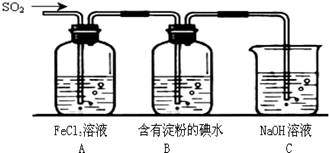
(1)装置A中的现象是__________。在SO2还原Fe3+的反应中SO2和Fe3+的物质的量之比是_______。
(2)装置C的作用是____________________________________。
(3)若要从A中的FeCl3溶液中提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、过滤,在这一系列操作中没有用到的玻璃仪器有( )
| A.烧瓶 | B.酒精灯 | C.漏斗 | D.烧杯 E.玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊。下图④中浓硫酸与木炭粉在加热条件下发生反应生成 CO2、SO2和H2O。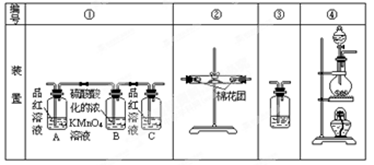
(1)在加热条件下,浓硫酸与木炭粉反应的化学方程式是: 。(2分)
(2)若用上图所列各装置设计一个实验,验证浓硫酸与木炭粉反应的产物,这些装置的连接顺序
(按产物气流从左至右的方向)是(填装置的编号) → → → 。(2分)
(3)B瓶溶液的作用是 。(2分)本实验中能说明二氧化硫具有漂白性的实验现象是 。(2分)③中反应的离子方程式为 。(2分)
(4)装置②中所盛是无水硫酸铜,现象是 。(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
Na2S2O3·5H2O(俗称海波或大苏打)是照相业常用的一种定影剂。
(一)常用下列途径制备海波:
已知反应:4FeS+7O2  2Fe2O3+4SO2、Na2SO3+S
2Fe2O3+4SO2、Na2SO3+S Na2S2O3
Na2S2O3
(1)计算原料FeS在反应(a)和(b)中的理论分配比:_________。
(2)现有88gFeS,设NaOH溶液吸收SO2的吸收率为96%,问最多制备海波质量为____克(精确到0.1克)
(二)工业上制得的海波晶体中可能含有少量的亚硫酸钠和硫酸钠杂质。为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液30mL,充分反应后过滤出硫,微热滤液使生成的SO2全部逸出(Na2S2O3+ H2SO4® Na2SO4+ SO2↑+ S↓+ H2O)。测得有关实验数据如下(标准状况):
| | 第一份 | 第二份 | 第三份 |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.80 | 1.60 | 3.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl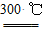 SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_______________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点-33 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下图(热源及夹持装置略去)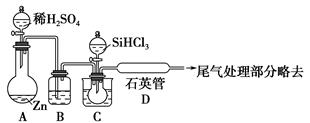
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是
________________________________________________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是__________________________________。
装置D中发生反应的化学方程式为_______________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及__________________________________________________
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是(填写字母代号)________。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液
e.Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
制备氮化镁的装置示意图如下: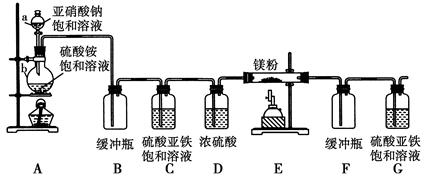
回答下列问题:
(1)检查装置气密性的方法是__________________________,
a的名称是________,b的名称是________。
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式________________________________。
(3)C的作用是________,D的作用是________,是否可以把C与D的位置对调并说明理由________。
(4)写出E中发生反应的化学方程式____________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学习兴趣小组探究氨气的制取实验:
(1)甲同学拟用下列实验方法制备氨气,其中合理的是 (填序号,下同)。
| A.将氯化铵固体加热分解 |
| B.将浓氨水滴入氢氧化钠固体中 |
| C.将氢氧化钠固体加入浓氨水中 |
| D.将氯化铵稀溶液滴入氢氧化钠固体中 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。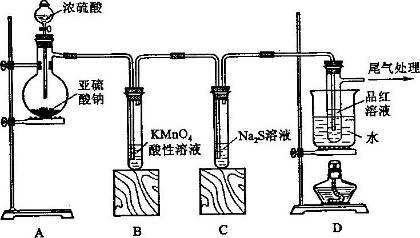
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是_________,其中发生反应的化学方程式_______________________;
(2)实验过程中,装置B、C中发生的现象分别是____________、___________,装置B中发生反应的离子方程式为_________________________________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象________________________;
(4)尾气可采用___________________溶液吸收。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com