
| A. | 将SO2通入石蕊试液中证明SO2有漂白性 | |
| B. | 用绿豆大小的钠和钾分别与冷水反应说明钠、钾金属性的强弱 | |
| C. | 向某未知溶液中加入BaCl2溶液后再加入稀硝酸,检验是否含SO42- | |
| D. | 用干燥的pH试纸可测得新制氯水的pH=2 |
分析 A.SO2通入石蕊试液,溶液变红;
B.分别与冷水反应,K与水的反应现象更剧烈;
C.检验硫酸根离子,应先加盐酸排除银离子等干扰;
D.氯水中含HClO,具有漂白性.
解答 解:A.SO2通入石蕊试液,溶液变红,可知其酸性氧化物的性质,与漂白无关,故A错误;
B.分别与冷水反应,K与水的反应现象更剧烈,则钠比钾金属性的弱,故B正确;
C.检验硫酸根离子,应先加盐酸排除银离子等干扰,再加氯化钡观察是否生成白色沉淀,故C错误;
D.氯水中含HClO,具有漂白性,不能利用pH试纸测定氯水的pH,应选pH计测定,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、离子检验、金属性比较、pH测定等,把握物质性质、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
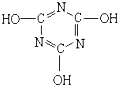 +H2O(未配平)下列有关三聚氰酸的说法不正确的是( )
+H2O(未配平)下列有关三聚氰酸的说法不正确的是( )| A. | 分子式为C3H3N3O3 | |
| B. | 分子中只含极性键,不含非极性键 | |
| C. | 属于共价化合物 | |
| D. | 该分子中的N原子采用sp杂化、C原子采用sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
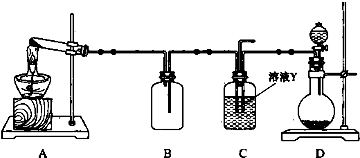
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠溶液中通入SO2产生白色沉淀,判断Si和S的非金属性强弱 | |
| B. | 比较H2O和H2S还原性强弱,判断O和S的非金属性强弱 | |
| C. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| D. | 铁片投入硫酸铜溶液中,铁片上有紫红色物质生成,判断Fe和Cu的金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可作袋装食品的干燥剂 | B. | 84消毒液的有效成分是NaClO | ||
| C. | 浓硫酸可刻蚀石英制艺术品 | D. | 氢氧化铝可作胃酸的中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “钡餐”中使用的硫酸钡是弱电解质 | |
| B. | 镀锌铁镀层破损后,铁更容易被腐蚀 | |
| C. | 提倡人们购物时不用塑料袋,是为了防止白色污染 | |
| D. | 推广使用太阳能、风能、海洋能、氢能,不利于缓解温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
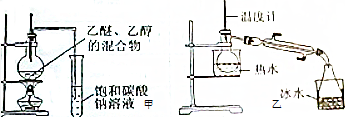
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com