
CO�Ǻϳ����ء������ԭ�ϡ�
��1����l00kPa��TK�£����ȶ���������1mol��������ʱ��Ϊ��������TKʱ�ı�Ħ�������ʣ��÷��š�H0��ʾ����֪ʯī��һ����̼��ȼ���ȷֱ�Ϊ393��5kJ/mol��283��0 kJ/mol����CO(g)�ġ�H0=________��
��2���ϳ����صķ�Ӧ��2NH3(g)+CO (g)=CO(NH2)2(g)+H2(g) ��H = - 81��0kJ/mol��T��ʱ�������Ϊ2L�ĺ����ܱ������У���2 mol��NH3��1mol CO��Ϸ�Ӧ��5 minʱ��NH3��ת����Ϊ80%����0��5minƽ����Ӧ����Ϊv(CO)= ��

��K1 126.5���>����< ���������ж������� �������ֺ��º��������������ʵ���֮��Ϊ3 mol��NH3��CO�Բ�ͬ�İ�̼�Ƚ��з�Ӧ�������ͼ��ʾ��
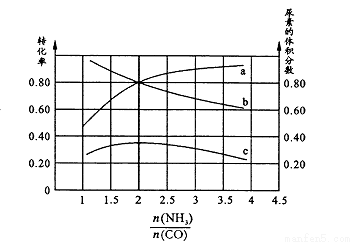
��ͼ��c��ʾƽ����ϵ�����ص������������a��ʾ________��ת���ʡ�
�ڵ� = ʱ�����غ������ʱ�����ڸ÷��������������Ӧ��������ʹƽ�������ƶ��Ĵ�ʩ�� ��дһ�֣���
= ʱ�����غ������ʱ�����ڸ÷��������������Ӧ��������ʹƽ�������ƶ��Ĵ�ʩ�� ��дһ�֣���
��3��ͨ���˹�������ÿɽ�COת����HCOOH����֪�����£�Ũ�Ⱦ�Ϊ0.1 mol��L��HCOOH��HCOONa�����ҺpH =3.7����HCOOH�ĵ��볣��Ka= ����֪lg2=0.3�����õ绯ѧ������HCOOH��ˮ����ɵ���Ⱦ����ԭ���ǵ��CoSO4��ϡ�����HCOOH�����Һ���õ�������Co3+��HCOOH������CO2��
��Co3+����HCOOH�����ӷ���ʽΪ ��
�ں�������仯�����ǰ��Co2+��Ũ�Ƚ� �����������С�����䡱����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���㽭ʡ��Ϫ�и߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶��£���2 L���ܱ������з������·�Ӧ��A(s)��2B(g) xC(g) ��H<0��B��C�����ʵ�����ʱ��仯�Ĺ�ϵ��ͼ1����ƽ�����t1��t2��t3��t4ʱ��ֻ�ı���һ���������淴Ӧ������ʱ��仯�Ĺ�ϵ��ͼ2��
xC(g) ��H<0��B��C�����ʵ�����ʱ��仯�Ĺ�ϵ��ͼ1����ƽ�����t1��t2��t3��t4ʱ��ֻ�ı���һ���������淴Ӧ������ʱ��仯�Ĺ�ϵ��ͼ2��

�����й�˵����ȷ����( )
A��x��2����Ӧ��ʼ2 min�ڣ�v(B)��0.1 mol/(L��min)
B��t1ʱ�ı�������ǽ��£�ƽ�������ƶ�
C��t2ʱ�ı����������������c(C)��ƽ��ʱB�����ʵ�����������
D��t3ʱ�����Ǽ�Сѹǿ��ƽ�ⲻ�ƶ���t4ʱ������ʹ�ô�����c(B)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���Ĵ�ʡ�߶��ϰ��ڿ��Ի�ѧ���������棩 ���ͣ�ѡ����
��ij��������һҺ�����ʱ��ƽ�Ӷ���Ϊ V1mL�����Ӷ���Ϊ V2mL�����Ӷ���Ϊ V 3 mL�� �� V 3 ��V 1��V 2������ʹ�����������ǣ� ��
A.����ƿ B.��Ͳ C.��ʽ�ζ��� D.������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ڳ����£�ij��ɫ��Һ�У���ˮ�������c(H+)��1��10-14 mol/L�������Һ�У�һ���ܴ��������������( )
A��K+��Na+��MnO4-��SO42- B��Na+��CO32-��AlO2-��Cl-
C��K+��Na+��Cl-��Br- D��K+��Cl-��Ba2+��HCO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ���¶��µĹ̶��ݻ����ܱ������У�������Ӧ��CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ��H��0����˵���÷�Ӧ�Ѵ�ƽ��״̬���ǣ� ��
CH3OH(g)+H2O(g) ��H��0����˵���÷�Ӧ�Ѵ�ƽ��״̬���ǣ� ��
A��CO2����������ڻ�������б��ֲ���
B�����������ܶȲ���ʱ��ı仯���仯
C����λʱ����ÿ����1.2m ol H2��ͬʱ����0.4mol H2O
ol H2��ͬʱ����0.4mol H2O
D����Ӧ��H2O��CH3OH�����ʵ���Ũ��֮��Ϊ1:1���ұ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���Ĵ�ʡ�ɶ��и�����ѧ��һ�ﻯѧ�Ծ��������棩 ���ͣ�ѡ����
�����£���0��1L0.1mol��L Na2S2O3��Һ��һ������pH=2��������Һ��ϣ��ų�VL���塣NA���������ӵ�������ֵ������˵����ȷ����
A��pH=2��������Һ����H+��ĿΪ0��0lNA
B���÷�Ӧ�ͷ�SO2������ĿΪ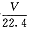 NA
NA
C����Ӧ��ÿĦ��Na2S2O3ת�Ƶĵ�����ĿΪ4NA
D����98gH2SO4����ˮ��ȫ���룬����ѵĹ��ۼ���ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡ�����и�����ѧ��һ�컯ѧ�Ծ��������棩 ���ͣ�ʵ����
ij̽����ʵ��С���ͬѧ����ĥ����þ��Ͷ�뵽���з�̪�ı���NaHCO3��Һ�У����ַ�ӦѸ�٣������������ݺͰ�ɫ�������Һ��dz��ɫ�����С��ͬѧ��ɫ������ijɷֽ�����̽����ȷ����
��������裺
��1����ͬѧ������ֻ��MgCO3��
��ͬѧ������ֻ�� ��
��ͬѧ��������xMgCO3��yMg(OH)2
��2����̽�������ɷ�ǰ���뽫��������Һ�й��ˡ�ϴ�ӡ����¸��ϴ�ӳ����IJ��������� ��
����ʵ��̽����
��3��ȡ�������������Թ��У�����ϡ����ʱ�����ܽ⣬�����������ݣ��� ͬѧ�������ѡ��ס������ҡ���������
����ʵ��̽����ȡһ�����Ѹ�����ij�����Ʒ����������װ�òⶨ����ɣ����̶ֹ��г���װ��δ����������ʵ��ǰ��Աȸ�װ�õ������仯��������������ɣ��ó���ͬѧ�ļ�������ȷ�ġ���ش��������⣺
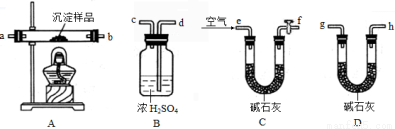
��4��ʵ���к���������˳��Ϊ��e�� �� �� �� �� �� g��h����װ��ֻʹ��һ�Σ���
��5��ʵ��һ��ʱ���Bװ���� ����ʵ������ֹͣ���ȣ�˵�������ѷֽ���ȫ����f���Ļ���������ͨ����������ӵ�Ŀ���� ��װ��C�м�ʯ�ҵ������� ��
��6��ָ����ʦ��Ϊ������ʵ��װ����ĩ�˻���������һ��Dװ�ã�����װ�ã���ʹ�����x ��y��ֵ ��ѡ�ƫ����ƫС������Ӱ�족����
��7�����Ľ�ʵ�������װ��B��������m�ˣ�װ��D����������n�ˣ���x ��y= �����ú�m��n�Ĵ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ�����и����ϵڶ��ν�ѧ������⻯ѧ���������棩 ���ͣ�ѡ����
�����£���20mL 0.2mol/LH2A��Һ�еμ�0.2 mol/L NaOH��Һ���й��������ʵ����仯��ͼ(����I����H2A�������HA-�������A2-)��ʾ������ͼʾ�жϣ�����˵����ȷ����
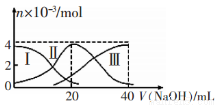
A����V(NaOH)=20 mLʱ����Һ������Ũ�ȴ�С��ϵ�� c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
B����Ũ�ȵ�NaOH��Һ��H2A��Һ�����2:1��Ϻ�����Һ��ˮ�ĵ���̶ȱȴ�ˮ��
C��NaHA��Һ�У�c(OH-)=c(H+)+c(HA-)+2c(H2A)
D������������20 mL NaOH��Һ��������Һ���ټ���ˮ�Ĺ����У�pH���ܼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡТ���и����ϵ�һ��ͳ����ѧ�Ծ��������棩 ���ͣ�ʵ����
�״�����Ҫ�Ĺ�ҵԭ�ϡ�ú������������ú̿��ȡˮú���Ӷ��ϳɼ״���
CO(g)+2H2(g) CH3OH(g)��
CH3OH(g)��
��֪�ٳ�ѹ�·�Ӧ�������仯��ͼ��ʾ��
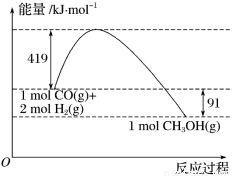
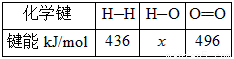
��
��CO(g)��1/2O2(g)===CO2(g) ��H=��280kJ/mol
H2(g)��1/2O2(g)===H2O(l) ��H=��284kJ/mol
H2O(l)===H2O(g) ��H=+ 44kJ/mol
��ش��������⣺
(1)��д����ʾ��̬�״�ȼ���ȵ��Ȼ�ѧ����ʽ_________________________��
(2)H��O���ļ���xΪ_________kJ/mol��
(3)�״�����ֽ�ΪCO��H2��������ķ�Ӧ�Ļ��Ϊ_________kJ/mol��
(4)��________(����¡����¡�)�����������CO��H2�Ʊ��״��ķ�Ӧ�Է����С�
(5)ij��ȤС��ͬѧ���ü״�ȼ�ϵ��̽���縡ѡ��������ˮ��һ�ַ�ʽ��������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe(OH )3������Fe(OH)3���������ԣ�������������������������о���ˮ�����á�װ������ͼ��ʾ��
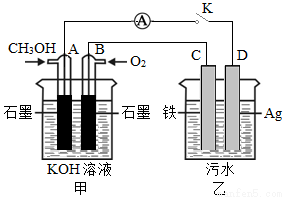
��д���׳ص�A���缫��Ӧʽ��______________________��
�����ҳ�ʵ��ʱ��ˮ������Ũ�Ƚ�С�����������ϲ��ˮЧ�����ã���ʱӦ����ˮ�м���������_______��
A��H2SO4
B��BaSO4
C��Na2SO4
D��NaOH
E��CH3CH2OH
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com