
| A. | 浓H2SO4滴在白纸上发黑,说明弄浓H2SO4具有脱水性 | |
| B. | 浓H2SO4和浓HCl混合可制氯化氢,说明浓H2SO4具有吸水性 | |
| C. | 常温下,浓H2SO4可以用铝罐贮存,说明铝与浓H2SO4不反应 | |
| D. | 反应CuSO4+H2S→CuS+H2SO4能在溶液中完全进行,证明CuS既不溶于水也不溶于稀H2SO4 |
分析 A、白纸滴入浓H2SO4,变黑色,白纸中的H、O以水的形式脱出;
B、浓H2SO4和浓HCl混合可制氯化氢,浓硫酸吸水放出热量,而氯化氢的沸点,易挥发;
C、铝与浓硫酸发生钝化现象,而不是不反应;
D、依据反应推知CuS不溶于硫酸,反应才能进行.
解答 解:A、白纸滴入浓H2SO4,变黑色,白纸中的H、O以水的形式脱出,则体现其脱水性,故A正确;
B、浓H2SO4和浓HCl混合可制氯化氢,浓硫酸吸水放出热量,而氯化氢的沸点,易挥发,所以说明浓H2SO4具有吸水性,故B正确;
C、铝与浓硫酸发生钝化现象,钝化是化学变化,故C错误;
D、依据反应推知CuS不溶于硫酸,符合复分解反应,反应才能进行,故D正确;
故选C.
点评 本题考查了浓硫酸的特性的分析判断,D选项物质溶解性的特征在化学方程式的分析利用,硫化铜不溶于酸,硫化亚铁溶于酸是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 苯分子中含有碳碳双键 | |
| B. | 烃是指只含有碳、氢元素的有机物 | |
| C. | 燃烧后能产生C02和H20的有机物一定是烃 | |
| D. | 葡萄糖溶液中加人新制Cu(OH)2悬浊液,振荡,产生砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A. | 第二份溶液中最终溶质为FeSO4 | |
| B. | OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | |
| C. | 原混合酸中NO3- 物质的量为0.1 mol | |
| D. | H2SO4 浓度为2.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
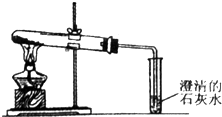
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
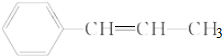 的说法正确的是( )
的说法正确的是( )| A. | 所有碳原子都可能在同一平面上 | |
| B. | 最多只可能有6个碳原子在同一平面上 | |
| C. | 有5个原子可能在同一直线上 | |
| D. | 所有原子可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ②④⑦⑧ | C. | ①⑤⑥⑦ | D. | ③⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “冰,水为之,而寒于水”说明相同质量的水和冰,冰的能量高 | |
| B. | 水加热到很高的温度都难以分解,主要原因是水分子间可以形成氢键的缘故 | |
| C. | 增大反应物浓度,可增大单位体积内活化分子数,使单位时间内有效碰撞次数增加 | |
| D. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com