
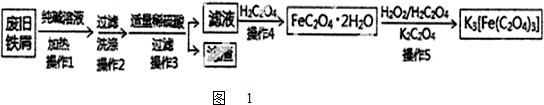
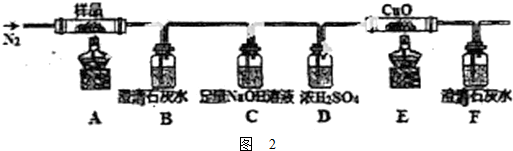
| 足量稀硝酸 |
| 搅拌 |
| 足量NaOH |
| 搅拌 |
| 过滤洗涤 |
| 烘干灼烧 |
| 足量稀硫酸 |
| 搅拌 |
| 测量气体体积 |
| 足量稀盐酸 |
| 溶解配制 |
| 每次取25mL溶液 |
| 用酸性KMnO4溶液滴定 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

 制成,合成路线如下:
制成,合成路线如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:1:1:1 |
| B、2:2:2:1 |
| C、1:2:2:1 |
| D、缺少条件,无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)>c(OH-)的任意水溶液 |
| B、加酚酞后显无色的溶液 |
| C、pH=6的某溶液 |
| D、能与金属Al反应放出H2的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
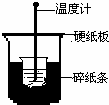 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
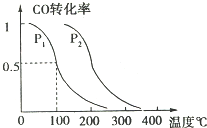 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com