
 乙烯是重要的化工原料,用乙烷脱氢制乙烯:
乙烯是重要的化工原料,用乙烷脱氢制乙烯:| 化学键 | C-H | C-C | C=C | H-H |
| 键能(kJ.mol-1) | 412 | 348 | 612 | 436 |
分析 (1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,反应热=吸收的总能量-放出的总能量;乙烷、乙烯的燃烧热分别为1559.8kJ-mol-l、1411kJ-mol-l,所以CH3CH3(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(l)△H=-1559.8kJ•mol-l,CH2═CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1411kJ•mol-l,根据盖斯定律求解;
(2)①v(H2)=$\frac{△c}{△t}$;根据三行式平衡时各物质的浓度,代入平衡常数表达式计算;
②由CH3CH3(g)$\stackrel{催化剂}{?}$CH2═CH2(g)+H2(g)△H=+124 kJ.mol-1,正反应是吸热反应,升高温度,平衡常数K增大;
③T℃下,若在2L的恒容密闭容器中充入的是0.6mol CH3CH3,相当于在原0.3 mol CH3CH3的基础上再增加了0.3 mol CH3CH3,相当于增压,CH3CH3转化率降低.
解答 解:(1)反应热=化学键断裂吸收的总能量-化学键形成放出的总能量,所以△H=6×412+348-4×412-612-436=+124,根据CH3CH3(g)+$\frac{7}{2}$O2(g)=2CO2(g)+3H2O(l)△H=-1559.8kJ•mol-l~~①,CH2═CH2(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1411kJ•mol-l~~②,CH3CH3(g)$\stackrel{催化剂}{?}$CH2═CH2(g)+H2(g)△H=+124 kJ.mol-1~~③,根据盖斯定律①-②-③得:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-272.8kJ.mol-1,故答案为:+124 kJ.mol-1;H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-272.8kJ.mol-1;
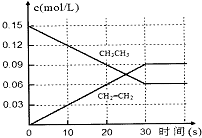
(2)①CH3CH3?CH2═CH2(g)+H2(g)
初起量:0.15 0 0
变化量:0.09 0.09 0.09
平衡量:0.06 0.09 0.09
所以:v(H2)=$\frac{△c}{△t}$=$\frac{0.09}{30}$0.003mol/( L•s),K=$\frac{0.09×0.09}{0.06}$=0.135 mol/L,故答案为:0.003mol/( L•s),0.135 mol/L;
②由CH3CH3(g)$\stackrel{催化剂}{?}$CH2═CH2(g)+H2(g)△H=+124 kJ.mol-1,正反应是吸热反应,升高温度,平衡常数K增大,故答案为:增大;该反应为吸热反应,升高温度,平衡正向移动,K增大;
③T℃下,若在2L的恒容密闭容器中充入的是0.6mol CH3CH3,相当于在原0.3 mol CH3CH3的基础上再增加了0.3 mol CH3CH3,相当于增压,CH3CH3转化率降低,故答案为:<;T℃,在2L容器中充入0.3 mol CH3CH3的转化率为60%,若充入的是0.6 mol CH3CH3,即相当于在原0.3 mol CH3CH3的基础上再增加了0.3 mol CH3CH3,相当于增压,CH3CH3转化率降低.
点评 本题主要考查了热化学方程式的书写,盖斯定律的应用、化学反应速率的计算和化学平衡常数的相关计算,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,同时还考查了反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.


科目:高中化学 来源: 题型:选择题
| A. | 60乙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HO3-和CO32-E离子数之和为0.1NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 同温、同压、同体积的CO和NO含有的质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中滴入石蕊试液后溶液呈蓝色,证明该溶液一定是碱的溶液 | |
| B. | 向某无色溶液中滴入硝酸银溶液产生白色沉淀,证明该溶液一定是盐酸 | |
| C. | 某白色固体与熟石灰混合研磨后产生有刺激性的氨味,证明该固体是铵盐 | |
| D. | 向某固体中加入稀盐酸产生气泡,证明该固体一定是碳酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质分子中均存在化学键 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 阴阳离子间通过静电引力而形成的化学键叫做离子键 | |
| D. | 只有金属元素和非金属元素化合时才能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原电池是化学对人类的一项重大贡献.
原电池是化学对人类的一项重大贡献.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同素异形体:是否由同一种原子构成 | |
| B. | 纯净物和混合物:是否只含一种元素 | |
| C. | 电解质和非电解质:溶于水或熔融状态下能否导电 | |
| D. | 氧化还原反应:元素化合价是否变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com