
| A. | I->Fe2+>Cl->SO2 | B. | Cl->Fe2+>SO2>I- | C. | Fe2+>I->Cl->SO2 | D. | SO2>I->Fe2+>Cl- |
分析 ①2FeCl3+2KI=2FeCl2+2KCl+I2中I元素的化合价升高,Fe元素的化合价降低;
②2FeCl2+Cl2=2FeCl3中,Fe元素的化合价升高,Cl元素的化合价降低;
③I2+SO2+2H2O=H2SO4+2HI中,S元素的化合价升高,I元素的化合价降低,结合还原剂的还原性大于还原产物的还原性来解答.
解答 解:①2FeCl3+2KI=2FeCl2+2KCl+I2中I元素的化合价升高,Fe元素的化合价降低,可知还原性I->Fe2+;
②2FeCl2+Cl2=2FeCl3中,Fe元素的化合价升高,Cl元素的化合价降低,可知还原性为Fe2+>Cl-;
③I2+SO2+2H2O=H2SO4+2HI中,S元素的化合价升高,I元素的化合价降低,可知还原性为SO2>I-,
综上所述,还原性为SO2>I->Fe2+>Cl-,
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、还原性的比较方法为解答的关键,侧重分析与应用能力的考查,注意基本概念的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
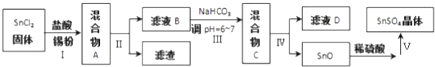
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、NO3- | B. | Fe3+、K+、Cl-、HCO3- | ||
| C. | Cu2+、Na+、Cl-、SO42- | D. | K+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
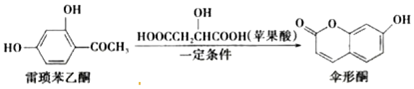
| A. | 雷琐苯乙酮有两种含氧官能团 | |
| B. | 1 mol伞形酮与足量 NaOH溶液反应,最多可消耗 2 mol NaOH | |
| C. | 伞形酮难溶于水 | |
| D. | 雷琐苯乙酮和伞形酮都能跟 FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中可能大量存在H+、Cl-、MnO4- | |
| B. | 大量氢离子的溶液中可能大量存在Na+、NH4+、SiO32- | |
| C. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2 O2+2H+═2Fe3++2H2O | |
| D. | 稀硫酸与Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3是钠盐 | B. | Na2CO3是含氧酸盐 | ||
| C. | Na2CO3是碳酸盐 | D. | Na2CO3是碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
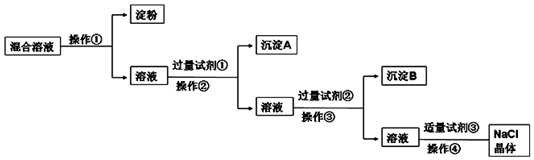
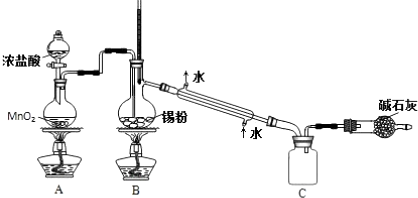
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42- 0.1 mol•L-1 | B. | Al3+ 0.2 mol•L-1 | ||
| C. | Cl- 0.3 mol•L-1 | D. | K+ 0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 平行实验编号 | Na2C2O4溶液 (mL) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
| 1 | 20.00 | 0.00 | 21.18 |
| 2 | 20.00 | 1.02 | 21.00 |
| 3 | 20.00 | 1.18 | 21.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com