
| A. | 是一种核素 | B. | 原子核内有8个中子 | ||
| C. | 与${\;}_{6}^{12}$C互为同位素 | D. | 比${\;}_{6}^{13}$C少一个电子 |
分析 A.具有一定数目质子和一定数目中子的一种原子叫做核素;
B.中子数=质量数-质子数;
C.质子数相同,中子数不同的原子互为同位素;
D.核外电子数=质子数.
解答 解:A.${\;}_{6}^{14}$C是质子数为6,中子数为6的一种核素,故A正确;
B.${\;}_{6}^{14}$C是质子数为6,质量为14,中子数为8,故B正确;
C.${\;}_{6}^{14}$C与${\;}_{6}^{12}$C的质子数均为6,中子数分别为8、6,互为同位素,故C正确;
D.${\;}_{6}^{14}$C与${\;}_{6}^{12}$C的质子数均为6,核外电子数都为6,故D错误;
故选D.
点评 本题考查原子的构成及原子中的数量关系,明确质量数、质子数、中子数的关系及同位素即可解答,较简单.


科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol•L-1) | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| C. | Fe2(SO4)3溶液和Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在元素周期表金属与非金属分界线附近能找到制半导体材料的元素 | |
| B. | 离子键、共价键、氢键都是化学键 | |
| C. | 元素周期律是元素原子核外电子排布周期性变化的必然结果 | |
| D. | 元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
| ② | 在FeCl2溶液中加入锌片 | Zn+Fe2+=Zn2++Fe | ||
| ③ | 在FeCl3溶液中加入足量铁粉 | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
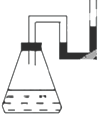 将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态.加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)( )
将下列物质分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水面呈现如图所示状态.加入的物质不可能是(不考虑加入物质引起的溶液体积的变化)( )| A. | 固体NaOH | B. | 浓H2SO4 | ||
| C. | Ba(OH)2•8H2O与NH4Cl糊状物 | D. | CaO固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸先在量筒中加一定体积水,再在不断搅拌下沿量筒壁慢慢加入浓硫酸 | |
| B. | 过滤时,漏斗里的滤液应低于滤纸的边缘 | |
| C. | 燃着的钠应立即用水灭火 | |
| D. | 测定溶液的pH值时,应用湿润玻棒蘸取待测液,直接滴在干燥的pH试纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
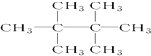 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7:2 | B. | 2:7 | C. | 1:2 | D. | 2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com