
【题目】钛(Ti)被称为继铁、铝之后的第三金属,用TiO2制取Ti的主要反应有①TiO2+2C+2Cl2![]() TiCl4+2CO、②TiCl4+2Mg
TiCl4+2CO、②TiCl4+2Mg![]() 2MgCl2+Ti。下列叙述正确的是
2MgCl2+Ti。下列叙述正确的是
A. 反应①是置换反应 B. 反应②是复分解反应
C. 反应①中TiO2是氧化剂 D. 反应②中金属镁具有还原性
【答案】D
【解析】
①反应TiO2+2C+2Cl2![]() TiCl4+2CO中C元素的化合价升高,Cl元素的化合价降低;②反应TiCl4+2Mg
TiCl4+2CO中C元素的化合价升高,Cl元素的化合价降低;②反应TiCl4+2Mg![]() 2MgCl2+Ti中Mg元素的化合价升高,Ti元素的化合价降低,以此来解答。
2MgCl2+Ti中Mg元素的化合价升高,Ti元素的化合价降低,以此来解答。
A.一种单质与一种化合物反应生成另一种单质和化合物的反应是置换反应,①中反应物有2种单质,生成物中没有单质,不符合置换反应的概念,故A错误;
B.复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应,②为置换反应,不符合复分解反应的概念,故B错误;
C.①中Ti、O元素的化合价不变,而Cl元素的化合价降低,则氯气为氧化剂,故C错误;
D.②中Mg元素的化合价升高,则Mg为还原剂,故D正确;
故答案选D。


科目:高中化学 来源: 题型:
【题目】关于反应2KI+O3+H2O ==2KOH+I2+O2,下列说法正确的是
A.当有2 molKI被氧化时,2 mol氧原子被还原
B.O2是还原产物
C.若消耗2.24 L O3,则转移0.2 mol电子
D.氧化剂与还原产物的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧产生的SO2、CO、NO2等造成了严重的大气污染问题。
(1) CaO能起到固硫、降低SO2排放量的作用。
已知:①SO2(g)+ CaO(s)=CaSO3(s) △H=-402 kJ·mol-1
②2CaSO3(s)+O2(g)=2CaSO4(s) △H=-234 kJ·mol-1
③CaCO3(s)=CO2(g) +CaO(s) △H = +178 kJ·mol-1
则反应2SO2(g)+O2(g)+2CaO(s)= 2CaSO4(s) △H =________ kJ·mol-1
向燃煤中加入CaCO3也可起到固硫作用,若固定2molSO2相应量的煤在相同条件下,燃烧时向环境释放出的热量会减少______ kJ。
(2)利用CO和H2在催化剂作用下合成甲醇,是减少污染的一种新举措,反应原理为CO(g)+2H2(g) ![]() CH3OH(g)△H,在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图甲。
CH3OH(g)△H,在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图甲。
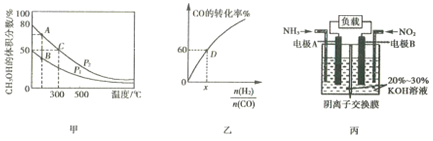
①上述合成甲醇的反应是______(填“吸热”或“放热”)反应,判断的理由是_____。
②图甲中A、B、C三点中反应速率最大的是______(填写“A”、“ B” 或“ C”)。
③在300℃时,向C点平衡体系中再充入0.25molCO,0.5molH2和0.25molCH3OH,该平衡______(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(3)一定温度下,CO的转化率与起始投料比![]() 的变化关系如图乙所示,测得D点氢气的转化率为40%,则x=______。
的变化关系如图乙所示,测得D点氢气的转化率为40%,则x=______。
(4)利用原电池原理可将NO2和NH3转化为无污染物质,其装置原理图如图丙所示,则负极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为![]() 。下列比较中正确的是( )
。下列比较中正确的是( )
A. 原子半径:a>c>d>b B. 电负性a>b>d>c
C. 原子序数:d>a>c>b D. 最高价含氧酸的酸性c>d>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的图解表示构成细胞的元素、化合物,a、b、c、d代表不同的小分子物质,A、B、E、F代表不同的大分子物质,请分析回答下列问题:
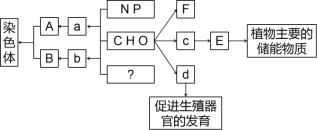
(1)在动物细胞内,与物质E作用最相近的物质是__________,若F为植物细胞细胞壁的主要成分,则它的合成主要发生在有丝分裂的________期。
(2)物质d和__________、胆固醇都属于固醇类物质。
(3)?处的元素为________,由多个b连接形成B的过程被称为_____________。
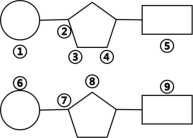
(4)下图为染色体结构中的一部分,若想将以下两个小分子以化学键连接起来,则连接的两点为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用氯酸钾和二氧化锰制取氧气的反应方程式为2KClO3![]() 2KCl+3O2↑。
2KCl+3O2↑。
回答下列问题:
(1)该反应中被氧化的元素的名称为____,生成1 mol O2时转移电子的数目是________。
(2)从反应后的固体混合物中分离出难溶于水的MnO2的具体实验操作名称:________。
(3)分离出的MnO2可用于实验室制取Cl2,化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,其离子方程式为________________________________。
MnCl2+Cl2↑+2H2O,其离子方程式为________________________________。
(4)若两个反应中转移的电子的物质的量相同,则生成的O2和Cl2在相同状况下的体积比为________。
(5)用双线桥法标明MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O电子转移的方向和数目_______。
MnCl2+Cl2↑+2H2O电子转移的方向和数目_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.丁达尔效应不是胶体特有的现象,溶液和浊液也有
B.胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有
C.胶体粒子的直径小于1nm
D.丁达尔效应可用于鉴别胶体和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有NaBr、NaI的溶液中通入过量的Cl2 , 然后将溶液蒸干,并灼烧固体,最后得到的物质是( )
A.NaCl
B.NaCl和NaBr
C.NaCl和NaI
D.NaCl和I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和浓盐酸之间有下列反应:
![]() KClO3 +
KClO3 + ![]() HCl(浓)==
HCl(浓)== ![]() KCl +
KCl + ![]() Cl2↑+
Cl2↑+ ![]() ClO2 +
ClO2 + ![]() H2O。
H2O。
(1)配平上述方程式_____________________。
(2)该反应氧化剂是__________,氧化产物是___________。
(3)当有0.4mol电子发生转移时,生成的氯气的体积为_____L(标准状况)。被氧化的HCl的物质的量为____mol。
(4)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+)③Ca(ClO)2(还原产物是Cl2)与浓盐酸反应制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com