
【题目】某实验小组设计用50 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1氢氧化钠溶液在如图装置中进行中和反应。试回答下列问题:
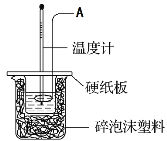
(1)仪器A的名称__________________________
(2)实验过程中下列操作正确是______________(填字母)。
A.用温度计小心搅拌
B.分多次加入氢氧化钠溶液
C.只进行一次实验,用所获得的数据计算中和热
D.用套在温度计上的A轻轻地上下搅动
(3)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________ (结果保留一位小数)。
(4)以下操作,会使测得的中和热ΔH发生怎样的变化?(填“偏大”“偏小”或“不变”)。
①量取稀盐酸时俯视量筒读数,测得的中和热ΔH会_______________ 。
②在中和热测定实验中未用水洗涤温度计上的盐酸直接测定碱的温度,测得的中和热ΔH会_______________。
③若用等浓度的醋酸与 NaOH 溶液反应,则测得的中和热ΔH会 __________,其原因是____________________________________________________________________________。
【答案】环形玻璃搅拌棒 D -51.8 kJ·mol-1 偏大 偏大 偏大 用醋酸代替盐酸,醋酸电离要吸收能量,造成测得的中和热偏小
【解析】
(1)根据量热器的构造可知,仪器A为环形玻璃搅拌棒;综上所述,本题答案是:环形玻璃搅拌棒。
(2)A.为使反应充分,应用环形玻璃搅拌棒上下慢慢搅拌,不能用温度计搅拌,错误;
B.分多次加入氢氧化钠溶液,易造成热量损失,测定的中和热数值偏小,应该一次性快速加入,错误;
C.为减小实验误差,实验应该做2-3次,计算出平均值,只进行一次实验,就用所获得的数据计算中和热显然是不行的,错误;
D.用套在温度计上环形玻璃搅拌棒的轻轻地上下搅动,使溶液混合均匀,减小实验误差,正确;
综上所述,本题选D。
(3)第1次实验盐酸和NaOH溶液起始平均温度为20.05℃,反应后温度为: 23.2℃,反应前后温度差为:3.15℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为: 23.4℃,反应前后温度差为: 3.1℃;
第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应后温度为: 23.6℃,反应前后温度差为: 3.05℃;
50 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1氢氧化钠溶液的质量和为m=100×1=100g,比热容c=4.18 J·g-1·℃-1;,代入公式Q=cmT得生成0.025mol的水放出热量Q=cmT=4.18×100×(3.15+3.1+3.05)/3=1.2959 kJ ;即生成0.025mol的水放出热量为:1.2959 kJ,所以生成1mol的水放出热量为1.2959×1/0.025=51.8 kJ;即该实验测得的中和热ΔH=-51.8 kJ·mol-1;综上所述,本题答案是:-51.8 kJ·mol-1。
(4)①量取稀盐酸时俯视量筒读数,所量取的盐酸体积偏小,盐酸总量减小,放出的热量会减小,测得的中和热ΔH会偏大;
②在中和热测定实验中未用水洗涤温度计上的盐酸直接测定碱的温度,酸碱发生中和,导致反应前后的温度变化量减小,放出的热量会减小,测得的中和热ΔH会偏大;
③用醋酸代替盐酸,醋酸电离要吸收能量,造成测得的中和热偏小,测得的中和热ΔH会偏大;
综上所述,本题答案是:偏大,偏大,偏大;用醋酸代替盐酸,醋酸电离要吸收能量,造成测得的中和热偏小。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某温度时,水的离子积常数 Kw = 1×10-13,将此温度下 pH = 11 的 Ba(OH)2溶液 a L 与 pH =1的 H2SO4 溶液 b L 混合(设混合溶液体积为两者之和,固体体积忽略不计)。下列说法不正确的是
A. 若 a∶b = 9∶2,则所得溶液 pH 等于 2
B. 若 a∶b = 9∶2,该混合溶液最多能溶解铁粉 0.28(a + b) g
C. 若所得混合溶液为中性,则 a∶b = 1∶1
D. 若所得混合溶液为中性,生成沉淀的物质的量为 0.05b mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1molKClO3放出热量38.8kJ,在MnO2下加热,KClO3的分解分为两步:
①2KClO3+4MnO2![]() 2KCl+2Mn2O7 慢
2KCl+2Mn2O7 慢
②2Mn2O7![]() 4MnO2+3O2 快
4MnO2+3O2 快
下列有关说法不正确的是
A. 1molKClO3所具有的总能量高于1molKCl所具有的总能量
B. 1gKClO3 ,1gMnO2,0.1gMn2O7混合加热,充分反应后MnO2质量仍为1g
C. KClO3分解速率快慢主要取决于反应①
D. 将固体二氧化锰碾碎,可加快KClO3的分解速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入气体X、Y、Z,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是

A. 该反应的化学方程式为2X+Y![]() 2Z
2Z
B. 反应开始至2min时,Z的平均反应速率为0.1 mol·L-1·min-1
C. 该反应为可逆反应
D. 4min时,X、Z的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 溶液呈电中性,胶体带电荷。
B. 配制0.1 mol·L-1CuSO4溶液100 mL,称取1.6g硫酸铜晶体
C. 向饱和Ca(OH)2溶液中加入少量无水CaO固体,恢复原温度,溶液中Ca(OH)2的物质的量浓度不变
D. 制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并长时间煮沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:

己知:甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25°C和95℃下溶解度分别为0.3g和6.9g。
i制备产品:将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
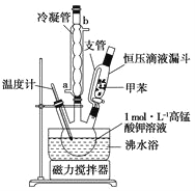
(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________。
(2)在本实验中,三颈烧瓶最合适的容积__________(填字母)。
A. 50mL B. I00mL C. 200mL D. 250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是___________________。
ii分离产品:该同学设计如下流程分离粗产品苯甲酸和回收甲苯

(3)操作Ⅰ的名称是___________;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是______________。
iii纯度测定
(4)称取1.220g产品,配成100mL甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH溶滴定(与苯甲酸恰好完全反应)。重复三次,平均每次消耗KOH溶液的体积24.00mL。样品中苯甲酸纯度为______________。
(5)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物,应采用___________法对样品提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售盐酸试剂瓶标签上的部分信息如下:
盐酸
化学式:HCl
相对分子质量:36.5
密度约1.18 g·mL-1
HCl的质量分数:36.5%
(1)该盐酸中HCl的物质的量浓度=_____。
(2)取该盐酸50 mL加水稀释到100 mL,则稀释后溶液中c(HCl)=____。该实验选用的主要仪器有:烧杯、量筒、玻璃棒、和_________。
(3)该操作的正确顺序为_____(填序号)。
a.反复颠倒摇匀 b. 稀释浓盐酸c.用胶头滴管加水至刻度线 d.用量筒量取浓盐酸e.将配制好的溶液转入试剂瓶中贴上标签f.将溶液转入容量瓶
(4)下列情况对所配制的稀盐酸浓度有何影响?用“偏大”“偏小”或“无影响”填写。
a.所用的浓盐酸长时间放置在密封不好的容器中_____。
b.用量筒量取浓盐酸时,仰视刻度线_____。
c.洗涤量取过浓盐酸的量筒,并将洗液注入容量瓶中_____。
d.定容时俯视容量瓶的刻度线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需化学元素。其配方如下表(培养液浓度单位:mmol/L),下列相关叙述正确的是:
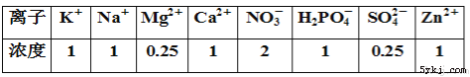
A. 表格中涉及的元素中植物吸收量最少的是S和Mg
B. 表格中包含了植物生存所需的各种元素
C. 对植物的生长发育而言,作用最小的是Zn2+元素
D. 除去Mg或者N,植物的光合作用都会受到影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=11的X、Y两种碱溶液各10mL,分别稀释至1000mL。其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )

A. X、Y两种碱的物质的量浓度一定相等
B. 稀释后,X溶液碱性比Y溶液碱性强
C. 若9<a<11,则X、Y都是弱碱
D. 完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX>VY
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com