
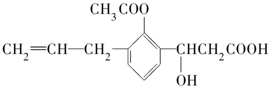
 某有机化合物的结构简式如下:此有机化合物属于( )
某有机化合物的结构简式如下:此有机化合物属于( )| A. | ①②③④ | B. | ②④ | C. | ②③ | D. | ①③ |
科目:高中化学 来源: 题型:选择题
 的不饱和度Ω为( )
的不饱和度Ω为( )| A. | 8 | B. | 7 | C. | 6 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,将粗铜与电源的负极相连 | |
| B. | 合成氨工业中,将NH3及时液化分离有利于加快反应速率 | |
| C. | 氯碱工业中,烧碱在阳极区生成 | |
| D. | 工业上通常使用电解法制备金属钠、镁、铝等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑥ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
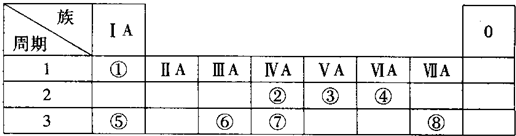
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:丁>丙>乙 | |
| B. | 甲的气态氢化物的水溶液呈酸性 | |
| C. | 乙与丙形成的化合物既能与酸反应,又能与碱反应 | |
| D. | 同周期元素中丁的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
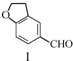 $\stackrel{CH_{2}(COOH)_{2}}{→}$
$\stackrel{CH_{2}(COOH)_{2}}{→}$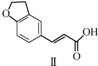 $→_{H_{2}}^{Pd-C}$
$→_{H_{2}}^{Pd-C}$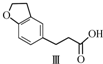
| A. | 不能用溴水区分化合物Ⅱ和化合物Ⅲ | |
| B. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| C. | 1 mol化合物Ⅰ最多能与3 mol H2发生加成反应 | |
| D. | 与化合物Ⅰ互为同分异构体,且分子中含有2个醛基的芳香族化合物有10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
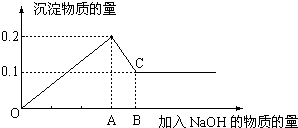
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com