
| A、①④⑥ | B、①③⑤ |
| C、①③⑤⑥ | D、③⑤⑥ |


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
| A、0.1mol/L的醋酸溶液中:c(CH3COOH)>c(H+)>c(CH3COO-) |
| B、0.1mol/L的明矾[KAl(SO4)2?12H2O]溶液中:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-) |
| C、等浓度的Na2CO3与NaHCO3混合溶液中:c(Na+)+c(H+)=c(HCO3-)+2 c(CO32-)+c(OH-) |
| D、稀硫酸中滴入氨水至中性后所得的溶液中:c(NH4+)=c(SO42-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 4 |
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4退色能在稀硫酸中水解 |
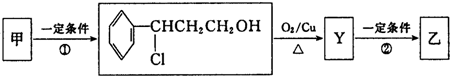

| iO3 |
| iiZn/H2O |
| ||
| ii H+ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径大小顺序为:E>D>C>B>A |
| B、A、B、C、D四种元素都属于非金属元素,它们之间只能形成共价化合物 |
| C、B、C、D、E四种元素与A 元素形成的最简单化合物的沸点依次升高 |
| D、D与A、E均可形成具有强氧化性的化合物,可用于城市自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
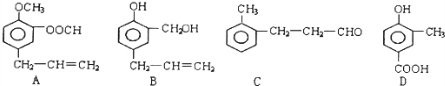

查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O)/mol?L-1 | 0.10 | 0.09 | 0.08 | 0.07 | 0.06 | 0.05 | 0.04 | 0.03 | 0.02 | 0.01 | 0.00 |
A、 |
B、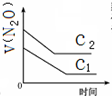 |
C、 |
D、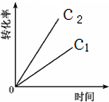 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com