
【题目】甲酸香叶酯是一种食品香料,可以由香叶醇与甲酸发生酯化反应制得。下列说法正确的是( )
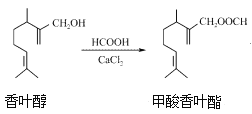
A. 香叶醇的分子式为C11H18O
B. 香叶醇在浓硫酸、加热条件下可发生消去反应
C. 香叶醇与CH2=CHCH=CHCH2OH互为同系物
D. 香叶醇与甲酸香叶酯均不能发生银镜反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列解释有关事实的方程式不正确的是
A.铝热法炼铁:Fe2O3+ 2Al![]() Al2O3+ 2Fe
Al2O3+ 2Fe
B.工业上用NH3制备NO:4NH3+ 5O2![]() 4NO十6H2O
4NO十6H2O
C.向受酸雨影响的湖泊中喷洒CaCO3粉末:CO![]() +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
D.淀粉酿酒:(C6H10O5)n+nH2O![]() n C6H12O6,C6H12O6
n C6H12O6,C6H12O6![]() 2C2H5OH+2CO2
2C2H5OH+2CO2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学配制一定物质的量浓度的NaOH溶液时,造成所配制溶液浓度偏高的原因是( )
A. 转移时容量瓶未干燥
B. 定容时俯视刻度线
C. 没有洗涤烧杯和玻璃棒
D. 用带游码的托盘天平称2.4 g NaOH时误用了“左码右物”方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,发生反应:2C(s)+2NO2(g)N2(g)+2CO2(g)反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是

A.T℃时,该反应的化学平衡常数为![]()
B.图中c点所示条件下,v(正)>v(逆)
C.向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡大
D.容器内的压强:Pa:Pb>6:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A. 在![]() 分子中含有1个手性C原子
分子中含有1个手性C原子
B. 氢键是一种特殊化学键,它广泛地存在于自然界中
C. 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子
D. 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
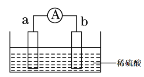
【题目】(1)如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则电子由_____(填“a”或“b”,下同) 极流向_____极,电解质溶液中![]() 移向_____极,a极上的电极反应式为___________________。
移向_____极,a极上的电极反应式为___________________。
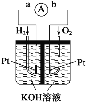
(2)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为___________,若将燃料改为CH4,写出其负极反应方程式_________。
(3)图为青铜器在潮湿环境中因发生电化学反应而被腐蚀的原理示意图。

①腐蚀过程中,负极是_________(填图中字母“a”或“b”或“c”);
②环境中的Cl- 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为_______________________;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为_______L(标况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生产生活中应用广泛。回答下列问题:
I.单质碘与氟反应可得IF5,实验表明液态IF5具有一定的导电性原因在于IF5的自偶电离(如:2H2OH3O++OH-),IF5的自偶电离方程式为_________。
II.一种回收并利用含碘(I-)废液的工艺流程如下:

(1)含碘废水中碘的存在形式一般有I2、I-。检验是否含I2及I-的方法是_______________。
(2)“沉淀”中生成CuI的离子方程式为_______________。
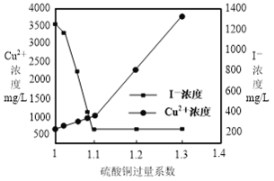
(3)CuSO4的投加量对废水中I-的去除量影响较大,不同投加量(用过量系数表示)下,反应后I-和Cu2+的浓度如图所示,则适宜的CuSO4过量系数应为_______________,分析原因_______________。
(4)反应Ⅰ中生成铁与碘的化合物(其中铁与碘的质量比为21:127),则加入的水的作用是__________,反应Ⅱ的化学方程式是_____________________________。
(5)氯化银复合吸附剂可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s) AgI(s)+Cl-(aq),反应达到平衡后溶液中c(Cl-)=0.10molL-1。则溶液中c(I-)= ______molL-1。[Ksp(AgCl)=2.0×10-10,Ksp (AgI)=8.4×10-17]。该方法能去除碘离子的原理是_________。
(6)准确称取产品0.1000g溶于50mL水,加入适量乙酸并加入曙红钠指示剂,然后用0.025mol·L-1AgNO3溶液滴定,至终点时消耗AgNO3溶液22.00mL,则产品中KI的质量分数为____________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com