
【题目】交警用三氧化铬(CrO3)硅胶可以查酒驾。元素Cr的几种化合物转化关系如图所示。下列判断正确的是
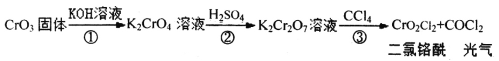
A.反应①表明CrO3有酸性氧化物的性质
B.CrO42-在碱性溶液中不能大量存在
C.只有反应③为氧化还原反应
D.基态铬原子的价电子排布式为3d44s2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
Ⅰ.(1)醋酸是常见的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_____(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
Ⅱ.白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
a 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
b 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
c 取20.00 mL配制的待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
d 重复滴定实验3次并记录数据。
e 计算白醋样品中醋酸总酸度。回答下列问题:
(2)实验a中量取20.00 mL白醋所用的仪器名称是___________。
(3)若实验b中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_________(填“偏大”、“偏小”或“不变”)。
(4)实验C中判断滴定终点的现象是_______。
(5)实验数据如下表,则该白醋样品中醋酸总酸度为_________ mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |
Ⅲ.25℃,向20.00 mL 0.100 0 mol·L1 CH3COOH中滴加0.100 0 mol·L-1 NaOH过程中,pH变化如下图所示。
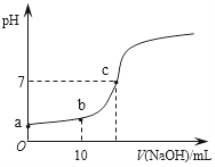
(6)a点溶液pH > 1,用电离方程式解释原因:_____________。
(7)下列有关b点溶液的说法正确的是_______(填字母序号)。
a 溶质为:CH3COOH、CH3COONa
b 微粒浓度满足:c(Na+) + c(H+) = c(CH3COO-) + c(OH)
c 微粒浓度满足:c(Na+) = c(CH3COOH) + c(CH3COO-)
d 微粒浓度满足:2c(H+) + c(CH3COO-) =2c(OH-) +c(CH3COOH)
(8)c点溶液中离子浓度的大小顺序:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析如图所示的四个原电池装置,其中结论正确的是
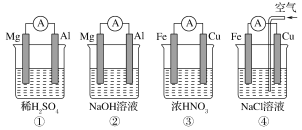
A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,正极反应式为6H2O+6e-==6OH-+3H2↑
C. ③中Fe作负极,电极反应式为Fe-2e-==Fe2+
D. ④中Cu作正极,电极反应式为2H++2e-==H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:[FeCl4(H2O)2]-呈黄色,由下列实验所得结论不正确的是( )
① | ② | ③ | ④ |
0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
酸化的0.1mol/L Fe2(SO4)3溶液 |
0.1mol/L FeCl3溶液 |
加热前溶液为浅黄色,加热后颜色变深 | 加热前溶液接近无色,加热后溶液颜色无明显变化 | 加入NaCl后,溶液立即变为黄色,加热后溶液颜色加深 | 加热前溶液为黄色,加热后溶液颜色变深 |
注:加热为微热,忽略溶液体积变化。
A.实验①中,Fe2(SO4)3溶液显浅黄色的原因是Fe3+水解产生了少量Fe(OH)3
B.实验②中,酸化对Fe3+水解的影响程度大于温度的影响
C.实验③中,存在平衡:Fe3+ +4Cl- +2H2O![]() [FeCl4(H2O)2]-
[FeCl4(H2O)2]-
D.实验④中,可证明升高温度,Fe3+水解平衡一定正向发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:
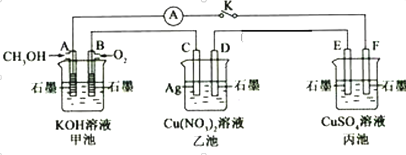
(1)甲池为__________(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为______________。
(2)丙池中E电极为_________(填“正极”、“负极”、“阴极”或“阳极”),电极的电极反应式为_____________。该池总反应的化学方程式为___________________。
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为_____mL(标准状况)。
(4)一段时间后,断开电键K,下列物质能使丙池恢复到反应前浓度的是___(填选项字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异黄酮类化合物在杀虫方面特别对钉螺有较好的杀灭作用,我国科学家研究了一种异黄酮类化合物的合成路线如下:
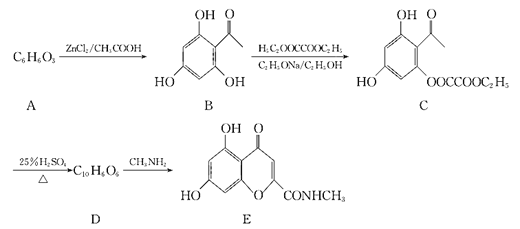
回答下列问题:
(1)A的化学名称为_________
(2)B中含氧官能团的名称是__________
(3)B到C的反应类型是_____________
(4)写出C与足量氢氧化钠溶液反应的化学方程式:____________
(5)D的结构简式为__________。
(6)写出与B互为同分异构体的能使Fe3+显色,且1mol该化合物最多可以消耗4molNaOH的化合物的结构简式(核磁共振氢谱为四组峰,峰面积比为1:2:2:3):_________。
(7)请设计由苯酚和溴丙烷为起始原料制备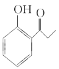 的合成路线___________ (无机试剂任选)。
的合成路线___________ (无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板是一种电子废弃物,某科研小组设计如下工艺流程回收铜并制取胆矾(流程中RH为萃取剂),下列说法正确的是

A.反应I的离子方程式为:Cu+H2O+2NH3+2NH4+==Cu(NH3)42++2H2O
B.操作②用到的主要仪器为蒸馏烧瓶
C.操作④以石墨为电极电解硫酸铜溶液:阳极产物为O2和H2SO4
D.操作⑤为:蒸发浓缩、冷却结晶、过滤、热水洗涤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容容器中,能标志某可逆反应2A(g)+2B(g)![]() C(g)+3D(g)己达平衡状态的是
C(g)+3D(g)己达平衡状态的是
A.混合气体的密度保持不变B.气体A的质量不随时间变化而变化
C.2v正(A)=3v逆(D)D.混合气体的压强不随时间变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物分别溶于水得溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是( )

A.Y可能是硅元素
B.简单离子半径:Z>W>X
C.气态氢化物的稳定性:Y>W
D.非金属性:Y>Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com