
下列说法正确的是
A.卢瑟福提出了带核的原子结构模型
B.地球上大量的氯蕴藏在大海中,因此氯被称为“海洋元素”
C.利用同位素治疗肿瘤证明任何同位素对人都不会造成危害
D.利用焰色反应可以鉴别所有金属元素
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:实验题
(13分)表示溶液浓度的方法通常有两种:溶液中溶质的质量分数(ω)和物质的量浓度(c),因此在配制溶液时,根据不同的需要,有不同的配制方法。请完成下列填空题。
(1)用10%(密度为1.00g·cm-3)的NaOH溶液配制成27.5g2%的NaOH溶液。
①计算:需______g10%(密度为1.00g·cm-3)的NaOH溶液,需加______mL水(密度为1.00g·cm-3)进行稀释。
②量取:用_______mL量筒(可供选择的量筒规格有:5mL、10mL、25mL、50mL,下同)量取10%的NaOH溶液,量取时视线要跟量筒内液体_______相切,然后倒入烧杯里,用______mL量筒量取蒸馏水注入烧杯里。
(2)把98%(密度为1.84g·cm-3)的浓硫酸稀释成3 mol/L的稀硫酸100mL,回答下列问题:
①需要量取浓硫酸___________mL(保留一位小数)。
②配制操作可分解成如下几步,正确的操作顺序是:___________。
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
C.把已冷却的稀硫酸注入经检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶的塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使液面达到刻度线
H.继续往容量瓶中加蒸馏水,使液面接近刻度线
③如果上述C操作中把未冷却的稀硫酸注入容量瓶中,所配溶液的浓度将_________ (填“偏高”、“偏低”或“无影响”,下同);如果上述D操作中量取浓硫酸后量筒内滞留的浓硫酸用少量蒸馏水洗涤并将洗涤液转入E操作中的小烧杯中,所配溶液的浓度将_________;如果上述G操作中目光仰视,所配溶液的浓度将_________;如果上述D操作中目光俯视,所配溶液的浓度将_________。
(3)实验室用NaOH固体配制1mol/L的NaOH溶液和用98%(密度为1.84g·cm-3)的浓硫酸配制1mol/L的H2SO4溶液各100mL。
①配制1mol/L的NaOH溶液,在用托盘天平称取NaOH固体时,天平读数为_______(填代号,下同)。
A.4.0g B.小于4.0g C.大于4.0g
②配制1mol/L的 H2SO4溶液,在烧杯中稀释浓硫酸的正确操作是: 。
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:选择题
把0.6molX气体和0.4molY气体混合2L于容器中使它们发生如下反应:3X(g)+Y(g)  nZ(g)+2W(g),5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·Lˉ1·minˉ1,则上述反应中Z气体的化学化学计量数n是:
nZ(g)+2W(g),5min末已生成0.2molW,若测知以Z浓度变化来表示的反应平均速率为0.01 mol·Lˉ1·minˉ1,则上述反应中Z气体的化学化学计量数n是:
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(解析版) 题型:选择题
某溶液中Cl-、Br-、I-三者物质的量之比是1∶2∶3,通入一定量的C12,当反应完后比值为3∶2∶1,则反应的Cl2和原溶液中I-的物质的量之比是
A.1∶2 B.1∶3 C.1∶4 D.1∶6
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(解析版) 题型:选择题
已知最外层电子数相等的元素原子具有相似的化学性质。氧元素原子的核外电子分层排布示意图为

下列原子中,与氧元素原子的化学性质相似的是
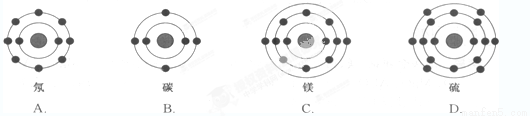
查看答案和解析>>
科目:高中化学 来源:2014秋河北省、临漳一中、永年二中高二上学期期中联考化学试卷(解析版) 题型:填空题
(12分)在100 ℃时,将0.100 mol N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(1)该反应的平衡常数表达式为________;从表中分析:
c1________c2,c3________c4(填“>”、“<”或“=”)。
(2)在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为________mol·L-1·s-1。
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是________(填字母序号)。
A.扩大容器的容积
B.再充入一定量的N2O4
C.分离出一定量的NO2
D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.080 mol NO2气体,则达到平衡时NO2气体的转化率为________。
查看答案和解析>>
科目:高中化学 来源:2014秋河北省、临漳一中、永年二中高二上学期期中联考化学试卷(解析版) 题型:选择题
在恒容条件下,能使NO2(g)+CO(g)? ?CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增加的措施是
?CO2(g)+NO(g)正反应速率增大且活化分子的百分数也增加的措施是
A.增大NO2或CO的浓度
B.减小CO2或NO的浓度
C.通入Ne使气体的压强增大
D.升高反应的温度
查看答案和解析>>
科目:高中化学 来源:2014秋河北省、临漳一中、永年二中高二上学期期中联考化学试卷(解析版) 题型:选择题
我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做
A.正极 B.负极 C.阴极 D.阳极
查看答案和解析>>
科目:高中化学 来源:2014秋江苏省东台市高二第一学期期中考试化学试卷(解析版) 题型:选择题
乙烯醚是一种麻醉剂,其合成路线如下,有关说法正确的是

A.X可能为Br2
B.X可能为HO-Cl
C.乙烯醚易溶于水
D.①②③反应类型依次为加成、取代和消去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com