
某研究性学习小组为了变废为宝,拟采用铅铬黄法对某电镀厂含铬废水进行处理,并生产出符合条件的铅铬黄(PbCrO4).设计实验如下:
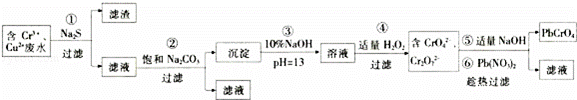
已知:a.该厂的废水中主要含Cr3+,还有少量Cu2+和其它可溶性杂质;
b.Cr(OH)3不溶于水,具有两性,pH=13时,发生反应:Cr(OH3)+OH﹣=﹣
回答下列问题:
(1)滤渣的成分是 (填化学式);第②步加入Na2CO3溶液的作用是 .
(2)第④步生成CrO42﹣的离子方程式为 .
(3)第⑤步加入NaOH的目的是为了提高铅铬黄的产率,请用化学平衡移动原理加以解释: .
(4)测定铅铬黄纯度:取mg铅铬黄样品溶解,加足量KI将其还原为Cr3+,再用 c mol•L﹣1 Na2S2O3标准液滴定(反应:2Na2S2O3+I2=Na2S4O6+2NaI),消耗体积VmL.该滴定实验中所需主要玻璃仪器有烧杯、 ,测定标准液体积的仪器事先进行洗涤所用试剂依次为 ;此铅铬黄样品的质量分数w=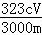 (用含c、m和V的式子表示).
(用含c、m和V的式子表示).
考点: 物质分离和提纯的方法和基本操作综合应用.
分析: 含Cr3+、Cu2+废水,加Na2S,铜离子会生成CuS沉淀,过滤,滤渣为CuS,滤液中含有Cr3+,在滤液中加饱和的碳酸钠溶液调节pH,使Cr3+完全沉淀为Cr(OH)3沉淀,过滤,滤渣中加氢氧化钠溶液,再加适量的双氧水,生成含有CrO42﹣、Cr2O72﹣的溶液,然后加氢氧化钠和硝酸铅,生成铅铬黄,趁热过滤,得到铅铬黄;
(1)根据流程分析判断;溶液中加入Na2CO3可以消耗氢离子,调节pH;
(2)﹣与双氧水反应生成CrO42﹣;
(3)由于溶液中存在化学平衡:Cr2O72﹣+H2O⇌2CrO42﹣+2H+,根据平衡移动原理分析;
(4)滴定时用到的仪器有滴定管、锥形瓶、烧杯;根据洗涤仪器的操作分析;由2CrO42﹣+6I﹣+16H+=2Cr3++3I2+8H2O、I2+2S2O32﹣=2I﹣+S4O62﹣ 可知,存在CrO42﹣~3S2O32﹣,以此计算,再求出质量和铅铬黄样品的质量分数.
解答: 解:含Cr3+、Cu2+废水,加Na2S,铜离子会生成CuS沉淀,过滤,滤渣为CuS,滤液中含有Cr3+,在滤液中加饱和的碳酸钠溶液调节pH,使Cr3+完全沉淀为Cr(OH)3沉淀,过滤,滤渣中加氢氧化钠溶液,再加适量的双氧水,生成含有CrO42﹣、Cr2O72﹣的溶液,然后加氢氧化钠和硝酸铅,生成铅铬黄,趁热过滤,得到铅铬黄;
(1)根据流程分析可知滤渣的成分是CuS;溶液中加入Na2CO3可以消耗氢离子,调节pH,使Cr3+完全沉淀为Cr(OH)3;
故答案为:CuS;调节溶液的pH,使Cr3+完全沉淀为Cr(OH)3;
(2)﹣与双氧水反应生成CrO42﹣和水,则第④步生成CrO42﹣的离子方程式为2﹣+3H2O2+2OH﹣=2CrO42﹣+8H2O;
故答案为:2﹣+3H2O2+2OH﹣=2CrO42﹣+8H2O;
(3)由于溶液中存在化学平衡:Cr2O72﹣+H2O⇌2CrO42﹣+2H+,当加入NaOH时,氢氧化钠消耗氢离子,有利于平衡正向移动,故提高了铅铬黄的产率;
故答案为:由于溶液中存在化学平衡:Cr2O72﹣+H2O⇌2CrO42﹣+2H+,当加入NaOH时,有利于平衡正向移动,故提高了铅铬黄的产率;
(4)溶解固体一般在烧杯中进行,滴定时标准溶液盛放在碱式滴定管中,待测溶液盛放在锥形瓶中,所以实验中用到的仪器有滴定管、锥形瓶、烧杯;
测定标准液体积的仪器事先进行洗涤,洗涤的方法为先用自来水洗,再用蒸馏水洗最后用待装溶液洗,则所用试剂依次为自来水、蒸馏水、标准液;
由2CrO42﹣+6I﹣+16H+=2Cr3++3I2+8H2O、I2+2S2O32﹣=2I﹣+S4O62﹣ 可知,
存在:CrO42﹣~3S2O32﹣,
1 3
n c mol•L﹣1×V×10﹣3L
则n=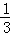 ×c mol•L﹣1×V×10﹣3L,
×c mol•L﹣1×V×10﹣3L,
则m(PbCrO4)=nM=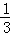 ×c mol•L﹣1×V×10﹣3L×323g/mol,
×c mol•L﹣1×V×10﹣3L×323g/mol,
所以铅铬黄样品的质量分数w=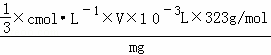 =
=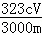 ;
;
故答案为:滴定管、锥形瓶;自来水、蒸馏水、标准液;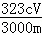 .
.
点评: 本题考查制备实验方案的设计,把握制备流程中混合物分离提纯、除杂及发生的反应为解答的关键,侧重分析能力、实验能力、推断及计算能力的综合考查,题目难度中等.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
下列溶液中氯离子浓度与50mL 1mol/L的AlCl3溶液中氯离子浓度相等的是()
A. 150mL 1mol/L的NaCl B. 75mL 2mol/L的NH4Cl
C. 150mL 3mol/L的KCl D. 75mL 2mol/L的CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表是一座开放的“元素大厦”,40号元素在元素周期表中的位置是()
A. 第四周期第ⅡA族 B. 第五周期第ⅣB族
C. 第五周期第IVA族 D. 第五周期第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池是工作时的电池反应为:PbO2+2H2SO4⇌2PbSO4+2H2O;试回答:
(3)铅蓄电池正极的电极材料是 .
(4)工作时该铅蓄电池负极的电极反应是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
将KO2放人密闭的真空容器中,一定条件下,发生反应:4KO2(s)⇌2K2O(s)+3O2(g),达到平衡后,保持温度不变,缩小容器体积,重新达到平衡.下列说法正确的是()
A. 容器内压强增大 B. KO2的量保持不变
C. 平衡常数减小 D. 氧气浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是()
A. 任何化学反应都伴随着能量的变化
B. 1 mol H2SO4和1 mol Ba(OH)2完全反应所放出的热量称为中和热
C. 在101 kPa时,1 mol碳燃烧放出的热量就是碳的燃烧热
D. 热化学方程式未注明温度和压强时,△H表示标准状况下的数据
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+3B(g)=4C(g)+2D(g),在不同条件下反应,其平均反应速率如下,其中反应速率最快的是()
A. v(A)=0.4mol/(L•s) B. v(B)=0.8mol/(L•s)
C. v(C)=1.2mol/(L•s) D. v(D)=0.7mol/(L•s)
查看答案和解析>>
科目:高中化学 来源: 题型:
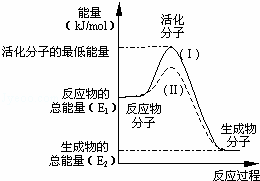
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ•mol﹣1表示.请认真观察下图,然后回答问题.
(1)图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)提供能量,该反应的△H= (用含E1、E2的代数式表示).
(2)已知热化学方程式:H2(g)+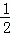 O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 .
O2(g)═H2O(g)△H=﹣241.8kJ•mol﹣1,该反应的活化能为167.2kJ•mol﹣1,则其逆反应的活化能为 .
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
对于某一达到平衡状态的可逆反应,如果改变某一条件而使生成物浓度增大,则()
A. 平衡一定向正反应方向发生了移动
B. 平衡一定向逆反应方向发生了移动
C. 反应物浓度相应减小
D. 平衡可能发生了移动,也可能没有发生移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com