
(18分)
Ⅰ.无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) = 2AlCl3 + 3H2
完成下列填空:
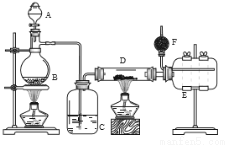
A为浓硫酸,B为NaCl固体
(1)进行实验时应先点燃 (选填“B”或“D”)处酒精灯。
(2)用粗短导管连接D、E的目的是________(选填序号)。
a.防堵塞 b.防倒吸 c.平衡气压 d.冷凝回流
(3)F中盛有碱石灰,其目的是 (选填序号)。
a.吸收多余HCl b.吸收Cl2
c.吸收CO2 d.防止空气中H2O进入E瓶
(4)将D中固体改为氯化铝晶体(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是 。若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为 。
Ⅱ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。Na2S2O5溶于水即生成NaHSO3。
(1)证明NaHSO3溶液中HSO3—的电离程度大于水解程度,可采用的实验方法是 (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(2)检验Na2S2O5晶体在空气中已被氧化的实验方案是________ ______。
(3)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量的方案如下:

(已知:滴定时反应的化学方程式为SO2 + I2 + 2 H2O = H2SO4 + 2 HI)
按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g/L。在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”、“偏低”或“不变”)。
1(1)B (2)a(3)ad(4)抑制AlCl3水解;4
2(1)a、e (2)取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成。(3) 0.16 偏低
【解析】
试题分析:Ⅰ.(1)先通过氯气排空装置中的空气,然后氯气与铝反应,所以进行实验时应先点燃B处酒精灯;
(2)氯化铝在178℃升华,降温时能凝结成固体,所以用粗短导管连接D、E的目的是防堵塞,答案选a。
(3)氯化氢是酸性气体,易污染空气,而氯化铝极易潮解,遇水后会发热并产生白雾,所以F中碱石灰的作用是吸收多余HCl和防止空气中H2O进入E瓶,答案选ad。
(4)氯化铝易水解生成氢氧化铝和氯化氢,所以通入HCl气体的目的是抑制AlCl3水解;设氯化铝晶体的物质的量是1mol,则根据铝原子守恒可知Al2(OH)nCl(6-n)的质量是0.5mol,则0.5×(54+17n+35.5×6-35.5n)=241.5×40%,解得n=4。
Ⅱ.(1)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl溶液、品红溶液都不能说明溶液呈酸性,故选ae;
(2)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成;
(3)令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.025L×0.01mol/L
所以,64g:mg=1mol:0.025L×0.01mol/L
解得m=0.016
故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为0.016g÷0.1L=0.16 g/L;
若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低。
考点:考查物质的制备实验、实验方案设计、物质含量的测定、氧化还原反应滴定等


科目:高中化学 来源:2014-2015学年广东省汕头市高三上学期期中理综化学试卷(解析版) 题型:选择题
下列各组离子在指定溶液中能大量共存的是
A.在无色溶液中: Na+、Cu2+、NO3- 、MnO4-
B.在含有HCO3-的溶液中:H+、K+、SO42-、Cl-
C.PH=1的溶液中:Na+、 K+、AlO2-、SO42-
D.常温下,水电离的c(H+)=10-12mol·L-1的溶液中:K+、Ba2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法中不正确的是
A.标准状况下,1.12L的H2O所含的原子数大于0.15NA
B.常温常压下,1mol甲基(—14C1H3)所含有的中子数和电子数分别为8NA和9NA
C.某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA
D.在1L0.1mol·L-1碳酸钠溶液中,阴离子总数大于0.1NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列表示物质结构的化学用语或模型正确的是
A.8个中子的碳原子的核素符号:12C
B.HF的电子式:
C.Cl-离子的结构示意图:
D.CH4分子的比例模型:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
气体X可能由NH3、Cl2、HBr、CO2中的一种或几种组成,已知X通入AgNO3溶液时产生浅黄色沉淀,该沉淀不溶于稀HNO3,若将X通入澄清石灰水中,无沉淀产生,则有关气体X的成分的下列说法正确的是
①一定含有HBr,可能含有CO2 ②一定不含CO2 ③一定不含NH3、Cl2 ④可能含有Cl2、CO2
A.①和③ B.只有③ C.只有① D.②和③
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.将过量SO2通入少量氨水中:SO2+2NH3·H2O==2NH4++SO32-
B.实验室用Cu和稀HNO3反应制取少量NO气体:Cu+4H++NO3- ==Cu2++NO↑+2H2O
C.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O
D.KIO3与KI在酸性溶液中反应:5I-+IO3-+3H2O==3I2+6OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:选择题
将一定量的铁粉加入到一定浓度的稀硝酸中,金属恰好完全溶解,反应后溶液中存在:c(Fe2+)∶c(Fe3+)=3∶2,则参加反应的Fe和HNO3的物质的量之比为
A.1∶1 B.5∶16 C.2∶3 D.3∶2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
下列叙述错误的是
A.CuSO4·5H2O是一种化合物
B.分散系一定是混合物
C.碱性氧化物不一定是金属氧化物
D.氯化银、冰醋酸、酒精、水银分别属于强电解质、弱电解质、非电解质、既不是电解质也不是非电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com