
分析 (1)发生反应:3NO2+H2O=2HNO3+NO,根据差量法计算NO2的体积,进而计算原混合气体中NO的体积;
(2)剩余的气体为NO,通入氧气发生反应:4NO+3O2+2H2O=4HNO3,据此计算参加反应NO的体积,进入试管的水的体积等于参加反应NO的体积;
(3)发生反应:4NO+3O2+2H2O=4HNO3、4NO2+O2+2H2O=4HNO3,根据方程式计算需要氧气的体积.
解答 解:(1)设原混合气体中NO2的体积为V,则:
3NO2+H2O=2HNO3+NO 体积减小
3 2
V 12mL
所以V=$\frac{12mL×3}{2}$=18mL
故NO的体积为24mL-18mL=6mL,
则原混合气体中NO和NO2的体积比为6mL:18mL=1:3,
故答案为:1:3;
(2)剩余的气体为NO,通入氧气发生反应:4NO+3O2+2H2O=4HNO3,由方程式可知通入3mL氧气时有4mLNO发生反应,故进入试管中的水的体积为4mL,故答案为:4;
(3)混合气体中NO的体积为6mL、NO2的体积比为18mL,由4NO+3O2+2H2O=4HNO3、4NO2+O2+2H2O=4HNO3,可知需要氧气的体积为:6mL×$\frac{3}{4}$+18mL×$\frac{1}{4}$=9mL,故答案为:9.
点评 本题考查化学方程式有关计算,注意利用差量法与总反应方程式进行解答,侧重于学生的分析能力和计算能力的考查,难度中等.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室用下列反应制取CO2和CO:H2C2O4$\stackrel{浓硫酸}{→}$CO2+CO+H2O,然后用如图所示装置将CO2和CO进行分离和干燥,已知分液漏斗中为稀硫酸,甲瓶中为NaOH溶液.试回答下列各题:
实验室用下列反应制取CO2和CO:H2C2O4$\stackrel{浓硫酸}{→}$CO2+CO+H2O,然后用如图所示装置将CO2和CO进行分离和干燥,已知分液漏斗中为稀硫酸,甲瓶中为NaOH溶液.试回答下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 50g46%的乙醇水溶液中,含H原子总数目为3NA | |
| C. | 7.8gNa2O2加入足量的水中,反应转移的电子总数目为0.2NA | |
| D. | 常温,21.0g乙烯和环丙烯的混合气体中含有的碳原子数为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有③④ | B. | 只有①② | C. | ①②③④ | D. | 只有②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ → → | B. | Na×+ →Na →Na | ||
| C. | Mg${\;}_{×}^{×}$+2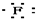 →Mg2+ →Mg2+ | D. |  +${\;}_{×}^{×}$C${\;}_{×}^{×}$ +${\;}_{×}^{×}$C${\;}_{×}^{×}$ → → |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com