
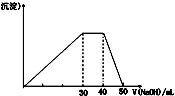
 学习化学要准确掌握化学基本概念和研究方法.按要求回答下列问题:
学习化学要准确掌握化学基本概念和研究方法.按要求回答下列问题:| | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| 第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
| 第二组 | NaOH | HCl | NaCl | Na2O | SO2 |
| 第三组 | NaOH | CH3COOH | CaF2 | Al2O3 | SO2 |
分析 (1)第一组中碳酸钠不是碱;第三组中氧化铝为两性氧化物;
(2)①2Na2O2+2H2O=4NaOH+O2反应中,每消耗2mol Na2O2生成1molO2,据方程式计算回答;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可以检验溶液中是否存在钡离子;
(3)反应中C从0价升高到二氧化碳中的+4价,K2Cr2O7中的Cr从+6价降为Cr2(SO4)3中的+3价,依据氧化还原反应得失电子守恒规律结合原子个数守恒规律配平方程式;
①依据硫酸在反应中元素化合价变化情况判断硫酸表现的性质;
②依据方程式3C+2K2Cr2O7+8H2SO4=2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O,每生成3mol二氧化碳,转移电子数为3mol×(4-0)=12mol,计算生成二氧化碳的物质的量,依据V=nVm计算标况下体积.
解答 解:(1)第一组中Na2CO3的说明是纯碱,但它属于正盐,不是碱;第二组中物质符合物质的分类知识,第三组中Al2O3能够与酸和强碱溶液反应,属于两性氧化物,不属于碱性氧化物,故答案为:Na2CO3、Al2O3;
(2)①2Na2O2+2H2O=4NaOH+O2反应中,每消耗2mol Na2O2生成1molO2,所以消耗1mol Na2O2生成0.5molO2,质量是16g,故答案为:16;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可以检验溶液中是否存在钡离子,滤液中加入硫酸钠溶液即可,故选:D;
(3)反应中C从0价升高到二氧化碳中的+4价,K2Cr2O7中的Cr从+6价降为Cr2(SO4)3中的+3价,要使氧化剂得到电子数等于还原剂失去电子数,则C系数为3,K2Cr2O7系数为2,依据原子个数守恒,反应的方程式:
3C+2K2Cr2O7+8H2SO4=2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O;
故答案为:3;2;8;2;3;2;8;
①硫酸在反应中元素化合价不变,所以只表现酸性,故选:C;
②依据方程式3C+2K2Cr2O7+8H2SO4=2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O,每生成3mol二氧化碳,转移电子数为3mol×(4-0)=12mol,所以若反应中电子转移了0.8mol,则产生的气体的物质的量为0.2mol,标况下体积为0.2mol×22.4L/mol=4.48L,故答案为:4.48.
点评 本题考查了物质的分类、氧化还原反应方程式配平、电子转移数目的计算,明确氧化还原反应得失电子守恒规律,熟悉各类物质的特点是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{92}^{235}$U相对原子质量为235 | |
| B. | ${\;}_{92}^{235}$U中的中子数为92 | |
| C. | ${\;}_{92}^{235}$U与 ${\;}_{6}^{12}$C的质量比约为235:12 | |
| D. | ${\;}_{92}^{235}$U 与${\;}_{92}^{238}$U互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验桌上的酒精灯倾倒了燃烧起来,马上用水扑灭 | |
| B. | 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦 | |
| C. | 皮肤上溅有较多的浓硫酸,赶紧用水冲洗 | |
| D. | 分液时,下层液体从下端放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的醋酸溶液与pH=12的氢氧化钠溶液等体积混合,混合后溶液pH=7 | |
| B. | 将0.1mol•L-1氢氧化钠溶液与pH=1稀硫酸等体积混合,混合后的溶液pH<7 | |
| C. | 硫酸铵溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | pH相同的醋酸钠溶液、碳酸氢钠溶液、碳酸钠溶液,其物质的量浓度: c(CH3COONa)>c(NaHCO3)>c(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
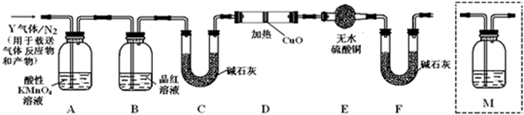
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 相关信息 |
| X | X元素可形成自然界中硬度最大的物质 |
| Y | 其单质为双原子分子,其最简单氢化物的水溶液能使酚酞变红 |
| Z | Z是短周期内最容易失去电子的元素 |
| M | M的一种同位素的质量数为34,中子数为18 |
| N | N是具有紫红色光泽的金属,有很好的延展性、导热性和导电性 |
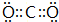 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量的H2与Cl2,H2的分子数一定比Cl2多 | |
| B. | 0.5mol氢的质量是0.5g | |
| C. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| D. | 0.1mol H2SO4含有氢原子数的精确值为1.204×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com