
| A. | NaOH的电子式: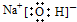 | |
| B. | 质子数和中子数均为16的硫原子:1616S | |
| C. | 氟原子的结构示意图: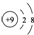 | |
| D. | 乙醛的结构简式: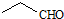 |
分析 A.氢氧化钠为离子化合物,钠离子直接用离子符号表示,氢氧根离子需要标出最外层电子及所带电荷;
B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
C.氟原子的核电荷数=核外电子总数=9,最外层为7个电子;
D.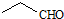 中含有3个碳原子,其名称为丙醛,而乙醛含有2个C.
中含有3个碳原子,其名称为丙醛,而乙醛含有2个C.
解答 解:A.氢氧化钠属于离子化合物,电子式中阴阳离子都需要标出所带电荷,其电子式为: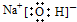 ,故A正确;
,故A正确;
B.质子数和中子数均为16的硫原子的质量数为32,该硫原子的正确表示方法为:1632S,故B错误;
C.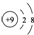 为氟离子结构示意图,氟原子的最外层含有7个电子,其正确的原子结构示意图为:
为氟离子结构示意图,氟原子的最外层含有7个电子,其正确的原子结构示意图为: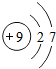 ,故C错误;
,故C错误;
D.乙醛分子中含有2个碳原子,其正确的结构简式为:CH3CHO,故D错误;
故选A.
点评 本题考查了常见化学用语的判断,题目难度中等,涉及原子结构示意图、电子式、元素符号、结构简式等知识,注意熟练掌握常见化学用语的概念及书写原则,明确离子结构示意图与原子结构示意图的区别,试题培养了学生规范答题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,分离出少量D,A的转化率提高 | |
| C. | 平衡时,升高温度,容器内混合气体的密度减小 | |
| D. | 平衡时,充入C,该反应平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
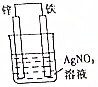 原电池原理的发现是储能和功能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和功能技术的巨大进步,是化学对人类的一项重大贡献.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
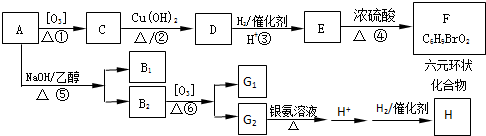
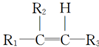 $\stackrel{[O_{3}]}{→}$
$\stackrel{[O_{3}]}{→}$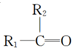 +
+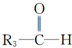
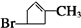

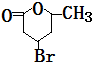 +H2O
+H2O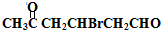 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$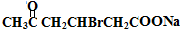 +Cu2O↓+3H2O
+Cu2O↓+3H2O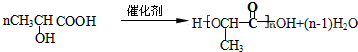
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向次氯酸钙溶液中通入过量CO2:2ClO-+Ca2++H2O+CO2═2HClO+CaCO3↓ | |
| C. | 向含0.015 molNaOH的溶液中通入0.64 g SO2:3OH-+2SO2═SO32-+HSO3-+H2O | |
| D. | 向Fe(OH)2中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
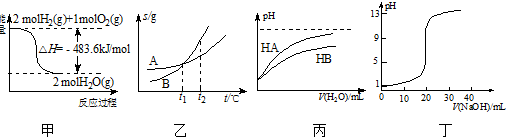
| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| B. | 乙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(B)>ω( A) | |
| C. | 丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度NaB溶液的pH | |
| D. | 丁表示0.1000 mol•L-1 NaOH溶液滴定20.00 mL 0.1000 mol•L-1醋酸溶液得到的滴定曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
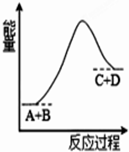
| A. | 该反应为释放能量 | |
| B. | 该反应为吸收能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应只有在加热条件下才能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
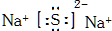 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com