
| A. | FeO→Fe2O3 | B. | CO2→CO | C. | H2S→Na2S | D. | AlCl3→Al(OH)3 |
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 辉石、斜长石及橄榄石均属于硅酸盐矿 | |
| B. | 橄榄石中铁为+2价 | |
| C. | 月球表层沙土中有游离态铁是因为月球的表面几乎没有氧气 | |
| D. | 斜长石的氧化物形式可表示为:K2O•Al2O3•3SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
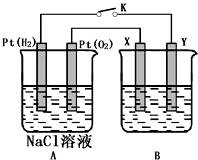 某化学兴趣小组用如图所示装置进行电化学原理的实验探究,试回答下列问题:
某化学兴趣小组用如图所示装置进行电化学原理的实验探究,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{13}$C | B. | 金刚石和石墨 | ||
| C. | CH3CH=CH2和环丙烷 | D. | 丁烷和异丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
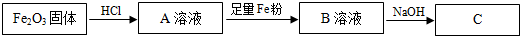
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
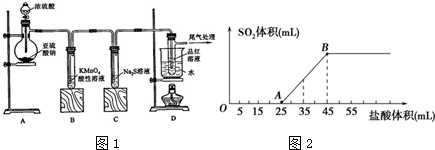
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g金属铁与一定量的硝酸反应时失去的电子数一定为3NA | |
| B. | 2mol SO2和1mol O2在密闭容器中加热(V2O5催化) 充分反应后,容器内分子总数为2NA | |
| C. | 1mol Cu和足量稀硝酸反应产生NA个NO分子 | |
| D. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中加入过量浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 向澄清石灰水中通入少量CO2:OH-+CO2═HCO3- | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | NH4HCO3溶于过量的浓KOH溶液中:NH4++OH-═NH3•H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com