
| 9×2+2-8 |
| 2 |
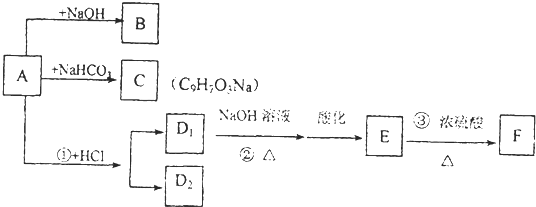
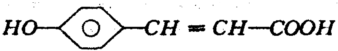 ,A和氢氧化钠溶液反应生成B,B的结构简式为:
,A和氢氧化钠溶液反应生成B,B的结构简式为: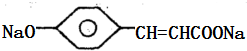 ,A和碳酸氢钠反应生成C,C的结构简式为
,A和碳酸氢钠反应生成C,C的结构简式为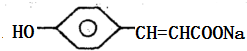 ,A和HCl发生加成反应生成D1 、D2,
,A和HCl发生加成反应生成D1 、D2,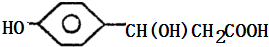 ,D1的结构简式为
,D1的结构简式为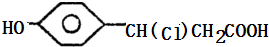 ,D2的结构简式为:
,D2的结构简式为: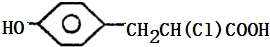 ,F的结构简式为
,F的结构简式为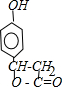 ,结合物质的结构和性质分析解答.
,结合物质的结构和性质分析解答.| 9×2+2-8 |
| 2 |
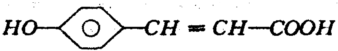 ,A和氢氧化钠溶液反应生成B,B的结构简式为:
,A和氢氧化钠溶液反应生成B,B的结构简式为: ,A和碳酸氢钠反应生成C,C的结构简式为
,A和碳酸氢钠反应生成C,C的结构简式为 ,A和HCl发生加成反应生成D1 、D2,
,A和HCl发生加成反应生成D1 、D2,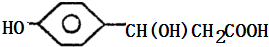 ,D1的结构简式为
,D1的结构简式为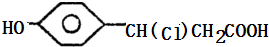 ,D2的结构简式为:
,D2的结构简式为: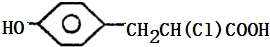 ,F的结构简式为
,F的结构简式为 ,
,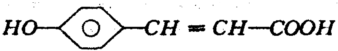 、
、 、
、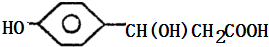 ,
,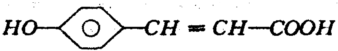 、
、 、
、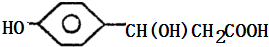 ;
;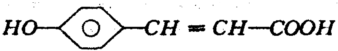 ,酚羟基的邻位、碳碳双键能和溴发生反应,所以1molA与足量浓溴水反应最多可消耗3molBr2,故A错误;
,酚羟基的邻位、碳碳双键能和溴发生反应,所以1molA与足量浓溴水反应最多可消耗3molBr2,故A错误;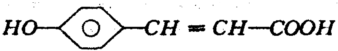 、
、 ,B中不含酚羟基,所以B不和氯化铁溶液发生显色反应,故B错误;
,B中不含酚羟基,所以B不和氯化铁溶液发生显色反应,故B错误;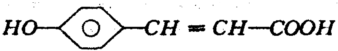 、
、 ,都含有碳碳双键,且连接苯环的碳原子上含有氢原子,所以都能被酸性高锰酸钾溶液氧化,所以都能使酸性高锰酸钾溶液褪色,故C正确;
,都含有碳碳双键,且连接苯环的碳原子上含有氢原子,所以都能被酸性高锰酸钾溶液氧化,所以都能使酸性高锰酸钾溶液褪色,故C正确;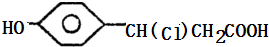 ,D2的结构简式为:
,D2的结构简式为: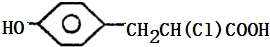 ,二者的分子式相同但结构不同,所以D1和D2两种物质互为同分异构体,故D正确;
,二者的分子式相同但结构不同,所以D1和D2两种物质互为同分异构体,故D正确;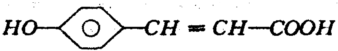 、
、 ,A和氢氧化钠发生中和反应,反应方程式为:
,A和氢氧化钠发生中和反应,反应方程式为: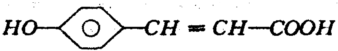 +2NaOH→
+2NaOH→ +2H2O,
+2H2O,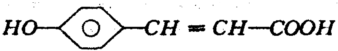 +2NaOH→
+2NaOH→ +2H2O.
+2H2O.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
| A、标准状况下,0.5NA二氧化硅约为11.2 L |
| B、向1L 1 mol/L氯化铝溶液中加入足量的氨水,生成AlO2-的个数为NA |
| C、2.7克铝与足量的氢氧化钠溶液反应,失去的电子数为0.3NA |
| D、1 mol铁与足量的氯气反应,失去的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.| 时间/min 物质 浓度 |
0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol?L-1 | 0.13mol?L-1 | 0.1mol?L-1 | 0.1mol?L-1 | 0.09mol?L-1 |
| H2 | 0mol?L-1 | 0.2mol?L-1 | 0.3mol?L-1 | 0.3mol?L-1 | 0.33mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向碳酸氢铵溶液中滴加过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | ||||
| B、硝酸亚铁溶液中滴加盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | ||||
| C、少量固体Mg(OH)2溶于饱和NH4Cl溶液中:2NH4++Mg(OH)2=2NH3?H2O+Mg2+ | ||||
D、用惰性电极电解MgCl2溶液:2Cl-+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 所需数据取值范围 | 生成CO2气体的体积 | |
| 盐酸不足量时 | ||
| 盐酸足量时 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 现象或操作 | 解释及结论 | |
| A | 将胆矾放入坩埚中加热脱水,晶体由蓝色变 为白色 | 胆矾晶体易失结晶水 |
| B | 苯酚中滴加溴水有白色沉淀 | 苯酚与溴发生了加成反应 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白 色沉淀生成 | 说明该溶液中含有SO42- |
| D | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支 管口 | 此位置指示的是被蒸馏物质的沸 点 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com