
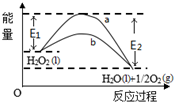
| A. | 有MnO2条件下的反应曲线是a曲线 | |
| B. | a曲线变为b曲线,反应所需的活化能降低 | |
| C. | a曲线变为b曲线,平衡时H2O2的转化率增大 | |
| D. | b曲线的热化学方程式为:H2O2(l)=H2O(l)+$\frac{1}{2}$O2(g)△H=-( E1-E2 )kJ•mol-1 |
分析 A.催化剂降低反应活化能而改变反应速率,但不影响平衡移动,则焓变不变;
B.催化剂降低反应所需活化能;
C.在双氧水的分解反应中,二氧化锰是正催化剂,增大反应速率但不影响平衡移动;
D.该反应的焓变为△H=(E1-E2)KJ•mol-1或△H=-(E2-E1)KJ•mol.
解答 解:A.催化剂降低反应活化能而改变反应速率,但不影响平衡移动,则焓变不变,所以有MnO2条件下的反应曲线是b曲线,故A错误;
B.催化剂降低反应所需活化能,故E1表示无催化剂时反应的活化能,b曲线表示有催化剂时反应的活化能,则a曲线变为b曲线,反应所需的活化能降低,故B正确;
C.在双氧水的分解反应中,二氧化锰是正催化剂,增大反应速率但不影响平衡移动,所以双氧水转化率不变,故C错误;
D.该反应的焓变为△H=(E1-E2)KJ•mol-1或)△H=-(E2-E1)KJ•mol-1,故D错误;
故选B.
点评 本题考查催化剂对化学反应速率影响,为高频考点,明确影响原理是解本题关键,注意催化剂只影响反应速率但不影响平衡移动,为易错点.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | c1:c2=1:3(若c1大于0) | |
| B. | 当4v(X)正=v(Y)逆时,该反应还在向正反应方向建立平衡 | |
| C. | c1=0.04 | |
| D. | 0≤c2≤0.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇既是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇既是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
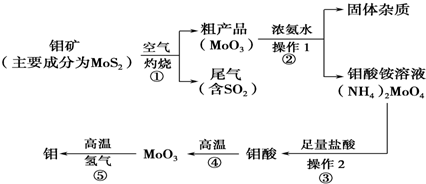
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
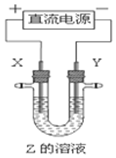 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 外加电流的阴极保护法中,Y是待保护金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| c/mol•L-1 | 0 | 0.036 | 0.030 | 0.026 | 0.022 | 0.017 | 0.016 | 0.015 | 0.015 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n(A-N+8)}{A+16}$mol | B. | $\frac{n(A-N+2)}{A}$ mol | C. | $\frac{n(A-N+8)}{A+8}$mol | D. | $\frac{n(A-N-2)}{A}$ mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com