
| V(标准)×c(标准) |
| V(待测) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、丁达尔现象可用来区别胶体与溶液 |
| B、胶体粒子能通过半透膜,不能通过滤纸 |
| C、胶体不稳定,在一定条件下会发生聚沉 |
| D、溶液、胶体、浊液的根本区别是分散质粒子直径的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
| c(CH3COO-)?c(H+) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 盐酸的体积(mL) | 标准NaOH溶液的体积(mL) |
| ① | 均是20.00 | 18.20 |
| ② | 17.10 | |
| ③ | 16.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表是元素周期表一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表一部分,表中所列字母分别代表某一化学元素.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | a | ||||||
| 2 | b | c | d | e | f | ||
| 3 | g | h |
| 代表符号 | b | c | d | e | f |
| 氢化物 沸点(℃) | 1317 | -161.5 | -33.33 | 100 | 19.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH溶液起始读数 | NaOH溶液终点读数 | |
| 第一次 | 0.02mL | 18.60mL |
| 第二次 | 0.04mL | 18.66mL |
| 第三次 | 0.20mL | 20.60mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将过量的SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 | 生成了BaSO3 |
| B | 常温下将Al片插入浓硫酸中 | 无明显现象 | Al片和浓硫酸不反应 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 将SO2通入溴水中 | 溶液褪色 | SO2具有漂白性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
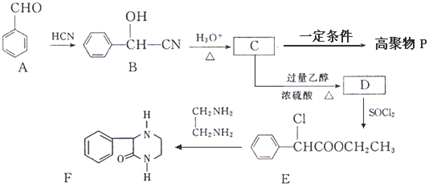
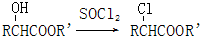 (R,R′代表氢原子或氰基)
(R,R′代表氢原子或氰基)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com