
| A、S+O2=SO2 |
| B、2Na+Cl2=NaCl |
| C、H2+Cl2=2HCl |
| D、CO2+H2O=H2CO3 |
科目:高中化学 来源: 题型:
| A、硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | ||
| B、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ | ||
C、将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO
| ||
| D、将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气 二氧化碳 氢氧化钠 |
| B、氯化钠 过氧化钠 氯化铵 |
| C、氯化钠 过氧化氢 氯化铵 |
| D、氯化钠 氦气 氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去FeCl3溶液中混有的少量FeCl2,可以向其中加入适量的稀硫酸 |
| B、分液时,分液漏斗中下层液体从下口流出后,再关闭活塞,将上层液体从上口倒出 |
| C、向100mL容量瓶中加入4.0g NaOH固体,然后加水到刻度线,配置1.0mol/L的NaOH溶液 |
| D、将(NH4)2SO4,CuSO4溶液分别加入到蛋白质溶液中,都出现沉淀,表明二者均可使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y、W的原子半径依次减小,对应的离子半径依次增大 |
| B、Z的氧化物与水反应可制得相应的含氧酸 |
| C、X、Y、W的最高价氧化物对应水化物之间互相都能发生反应 |
| D、Y的氧化物是两性氧化物,也是活泼金属氧化物,可以和水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室中的浓硝酸呈现黄色,是因为浓硝酸具有强氧化性 |
| B、加入稀盐酸,产生无色并能使澄清石灰水变浑浊的气体,原溶液一定有CO32- |
| C、NO和NO2密度比空气大,所以均可用向上排空气法收集 |
| D、在海轮外壳上镶入锌块可减缓船体的腐蚀速率,是利用了原电池的原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
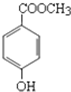 尼泊金酯是一种高效食品防腐剂,其结构简式为:
尼泊金酯是一种高效食品防腐剂,其结构简式为:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com