
【题目】氢能的存储是氢能应用的主要瓶颈,2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子.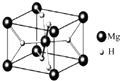
(1)C60晶体易溶于苯、CS2 , 说明C60是 分子(选填:“极性”、“非极性”);
(2)1mol C60分子中,含有σ键数目为 .
(3)MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度agcm﹣3 , 则晶胞的体积为 cm3[用a、NA表示阿伏加德罗常数].
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是某常见元素M的单质及其化合物间的转化关系图,其中X,Y,Z,W四种物质中均含有元素M,E是另一种单质,下列有关说法中不正确的是( ) ![]()
A.W可能是硫酸
B.Y不可能是Mg
C.X可能是钠
D.Z可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
(1)按电子排布,Q元素在周期表中属区.
(2)第一电离能YZ,电负性YZ(填“>”,“=”或“<”).
(3)W与Z形成的常见化合物有W2Z、W2Z2 , W与Y能形成多种二元化合物,如YW3、Y2W4、Y3W5、Y4W6…,W2Z分子中Z原子的杂化类型为 , YW3分子的立体构型为 , YW3极易溶于W2Z的主要原因有 .
(4)若向含有Q2+的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有深蓝色晶体析出,该晶体阳离子中含有的化学键有 .
(5)Q+与Y3﹣形成的晶胞结构如图所示,阴、阳离子间的核间距为 a pm,阿伏伽德罗常数用NA 表示,则晶体的密度为gcm﹣3 . 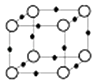
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来对CO2的有效控制及其高效利用的研究正引起全球广泛关注.由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=﹣49.58kJmol﹣1
反应Ⅱ:CO2(g)+H2(g)CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)CH3OH(g)△H3=﹣90.77kJmol﹣1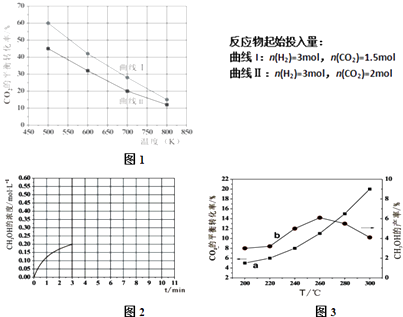
回答下列问题:
(1)反应Ⅱ的△H2= , 反应Ⅲ自发进行条件是(填“较低温”、“较高温”或“任何温度”).
(2)在一定条件下2L恒容密闭容器中充入一定量的H2和CO2仅发生反应Ⅰ,实验测得在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示.
①据图可知,若要使CO2的平衡转化率大于40%,以下条件中最合适的是
A.n(H2)=3mol,n(CO2)=1.5mol; 650KB.n(H2)=3mol,n(CO2)=1.7mol;550K
C.n(H2)=3mol,n(CO2)=1.9mol; 650KD.n(H2)=3mol,n(CO2)=2.5mol;550K
②在温度为500K的条件下,充入3mol H2和1.5mol CO2 , 该反应10min时达到平衡:
a.用H2表示该反应的速率为;
b.该温度下,反应I的平衡常数K=;
c.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min内容器中CH3OH浓度的变化趋势曲线:
(3)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得在不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图3所示,请回答问题:
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是(选填编号).
A.改用高效催化剂 B.升高温度C.缩小容器体积 D.分离出甲醇 E.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而(填“增大”、“减小”、“不变”或“无法判断”),其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 苯的空间构型是立方体结构
B. 油脂皂化反应可用硫酸作催化剂
C. 淀粉溶液中加入硫酸,加热4~5 min,再加入少量银氨溶液,加热,有光亮银镜生成
D. 福尔马林能使蛋白质发生变性,可用于浸制动物标本
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K= ![]() .有关该平衡体系的说法正确的是( )
.有关该平衡体系的说法正确的是( )
A.当混合气体的平均相对分子质量保持不变时,反应达平衡
B.增大压强,各物质的浓度不变
C.升高温度,平衡常数K增大
D.增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学电源的叙述正确的是
A. 化学电源比火力发电对化学能的利用率高
B. 化学电源所提供的电能居于人类社会现阶段总耗电量的首位
C. 化学电源均是安全、无污染的
D. 化学电源即为充电电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用锌片与1 mol·L-1稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是
A. 对该反应体系加热
B. 用浓硫酸代替稀盐酸
C. 不用锌片,改用锌粉
D. 加入少量1 mol·L-1硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于强、弱电解质的叙述不正确的是
A.强电解质在溶液中完全电离成阴、阳离子
B.强电解质溶液导电能力不一定比弱电解质溶液导电能力强
C.同一弱电解质同浓度的溶液,温度不同时,导电能力不同
D.强电解质易溶于水,弱电解质一定难溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com