
| A. | HCl→H2 | B. | CO2→CO | C. | Fe2O3→Fe | D. | Br-→Br2 |
科目:高中化学 来源: 题型:选择题
| A. | 原电池反应的本质是氧化还原反应 | |
| B. | 化学反应能量变化的主要原因是化学键的断裂与形成 | |
| C. | 石墨转化为金刚石的反应是吸热反应,说明金刚石比石墨稳定 | |
| D. | 元素周期律的实质是元素原子核外电子排布呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,48g O3含有的分子数为NA | |
| B. | 1molNa2O2晶体中阴离子数为2 NA | |
| C. | 标准状况下,33.6L的 四氯化碳(CCl4)中含有的碳原子数目为1.5NA | |
| D. | 常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
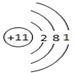 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com