
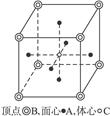
| A.全部由非金属元素组成的化合物一定不是离子化合物 |
| B.金属原子与非金属原子之间的化学键可能是离子键,也可能是共价键 |
| C.晶体中有阳离子,则必定有阴离子 |
| D.晶体中有阴离子,则必定有阳离子 |
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
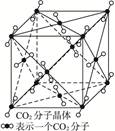 ?
?查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金刚石晶体中的最小碳原子环由6个碳原子构成 |
| B.Na2O2晶体中阴离子与阳离子数目之比为1∶1 |
| C.1 mol SiO2晶体中含2 mol Si—O键 |
| D.金刚石化学性质稳定,即使在高温下也不会和O2反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
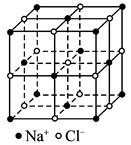
| A.7∶8 | B.13∶14 | C.25∶26 | D.26∶27 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子晶体中只含离子键 |
| B.含有离子键的晶体一定是离子晶体 |
| C.离子晶体中可能含共价键 |
| D.离子晶体不一定由金属阳离子和非金属阴离子构成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2和SiO2 | B.CO2和H2O | C.Na2O2和H2O2 | D.NaCl和HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com