
【题目】常温下,下列各组粒子在指定溶液中能大量共存的是
A.pH=l的溶液中:CH3CH2OH、Cr2O72—、K+、SO42-
B.NaHCO3溶液中:![]() 、CO32-、Br-、K+
、CO32-、Br-、K+
C.加入铝粉放出大量H2的溶液中:Fe2+、K+、Cl-、NO3-
D.C(Ca2+)=0.1 mol·L-1的溶液中:NH4+、SO42-、CH3COO-、Br-
科目:高中化学 来源: 题型:
【题目】已知:①2H2(g)+O2(g)=2H2O(l);△H=-572kJ/mol
②2H2(g)+O2(g)=2H2O(g);△H=-484kJ/mol
③CH4(g)+2O2(g)=2H2O(l)+CO2(g);△H=-890kJ/mol
(1)已知H-H的键能436kJ/molO=O的键能496kJ/molH-O的键能463kJ/mol,根据上述数据计算①②哪一个反应可以通过键能直接计算得出 。并计算写出反应 H2O ( l ) = H2O ( g )的焓变△H= 。
(2)请根据题干计算CO2(g)+4H2( g ) =CH4( g ) +2H2O( g )的焓变△H= 。
(3)在①②③三个方程式中哪一个是燃烧热的热化学方程式 。(填反应方程式的序号)标准状况下,取甲烷和氢气的混合气体11.2 L完全燃烧后恢复到常温,则放出的热量为263.8kJ,试求混合气体中甲烷和氢气体积比 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)写出下列仪器的名称:①____________,②____________,④____________。
(2)仪器①~④中,使用时必须检查是否漏水的是________________(填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器____________,将仪器补充完整后进行的实验操作的名称为____________;②的进水口是____________(填“f”或“g”)。
(4)现需配制250mL、0.2 mol·L-1NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误操作:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处有化学,下列表述不正确的是( )
A.严禁乱弃废电池,防止重金属污染土壤和水源
B.皮肤沾有油脂时,立即用氢氧化钠稀溶液擦洗
C.硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料
D.用含橙色酸性重铬酸钾的仪器检验酒驾,利用了乙醇的挥发性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列说法正确的是
A.在标准状况下,22.4LCCl4中含5 NA 个原子
B.0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.1 NA
C.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1 NA
D.将100mL0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人对某种有机物小分子物质的样品进行分析,发现含有C、H、O、N、P等元素,这种有机小分子物质可能是
A.蛋白质 B.RNA C.麦芽糖 D.脱氧核苷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)检验某溶液中是否含SO42-的正确操作顺序是:取少量未知溶液,加入____________________,若出现 现象,再加入_____________,若出现 现象,证明原溶液含有SO42-;BaSO4和NaCl的悬浊液在分离过程中涉及到过滤、洗涤沉淀操作,证明滤纸上的BaSO4沉淀已经洗净的方法是_______________。
(Ⅱ)现有A、B两种有机物的液体混合物,如果A、B互溶,且相互不发生化学反应。在常压下,A的沸点为35℃,B的沸点为200℃。回答下列问题:
(1)分离上述A、B的混合物,常用的方法是 ,需要的玻璃仪器有酒精灯、温度计、牛角管、蒸馏烧瓶,还有 和 (每空1分)。
(2)应用上述分离操作,首先得到的物质是 。
(3)点燃酒精灯前的最近一步操作是 。
(Ⅲ)下图是硫酸试剂瓶标签上的内容:
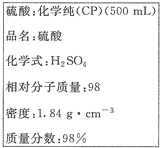
(1)该硫酸的物质的量浓度是 mol·L-1。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol·L-1的稀硫酸,则需要取 mL的该硫酸。将上述硫酸进行稀释的实验操作为 。
(3)用上述硫酸配制240 mL 4.6 mol·L-1的稀硫酸,实验仪器有:
①50 mL量筒 ②100 mL量筒 ③托盘天平 ④玻璃棒
⑤250 mL容量瓶 ⑥胶头滴管 ⑦烧杯 ⑧锥形瓶
实验时使用选用仪器的先后顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数___________。
(2)混合后溶液的物质的量浓度_____________。
(3)在1000g水中需溶解_____________摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com