
分析 (1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;根据三段式计算平衡时各组分的浓度,代入平衡常数表达式计算;
(2)该温度下PCl5的转化率=$\frac{消耗量}{起始量}$×100%;
解答 解:(1)PCl5的起始浓度为$\frac{2mol}{10L}$=0.2mol/L,达到平衡后,测得容器内PCl3的浓度为0.150mol/L,则:
PCl5(g)?PCl3(g)+Cl2(g)
开始(mol/L):0.2 0 0
变化(mol/L):0.15 0.15 0.15
平衡(mol/L):0.05 0.15 0.15
所以平衡常数k=$\frac{c(PC{l}_{3})c(C{l}_{2})}{c(PC{l}_{5})}$=$\frac{0.15×0.15}{0.05}$=0.45;
答:该温度下该反应的平衡常数为0.45;
(2)该温度下PCl5的转化率=$\frac{0.15mol/L}{0.2mol/L}$×100%=75%,
答:该温度下PCl5的转化率75%;
点评 本题考查化学平衡常数、转化率的计算,书写平衡常数是关键,注意三段式解题法的运用,注意当反应中有固体物质参加时,固体的“浓度”作为常数,在平衡常数表达式中,就不写固体的浓度,稀溶液中的水分子浓度可不写,对于非水溶液中的反应,溶剂的浓度同样是常数,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 溶液中I-浓度减小 | B. | 溶度积常数Ksp增大 | ||
| C. | 沉淀溶解平衡向左移动 | D. | 溶液中Pb2+浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO和KCl | B. | CuO和NaCl | C. | BaSO4和CaCO3 | D. | NaCl和AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有1mol K2SO4 | B. | 1molK2SO4溶于1L水中 | ||
| C. | 溶液中c(K+ )=2mol/L | D. | 1L 溶液中含2molK+,4mol O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能确定 | B. | 为40mL | C. | 为10mL | D. | 大于为40mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
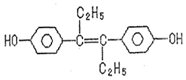
| A. | 可与NaOH和NaHCO3发生反应 | |
| B. | 可以用有机溶剂萃取 | |
| C. | 1mol该有机物可以与5molBr2发生反应 | |
| D. | 该有机物分子中,可能有18个碳原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AX | B. | BX | C. | AY | D. | BY |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnS的Ksp比CuS的Ksp小 | |
| B. | 该反应达平衡时c(Mn2+)=c(Cu2+) | |
| C. | 设该反应的平衡常数为K,则该关系成立:K×Ksp(CuS)=Ksp(MnS) | |
| D. | 往平衡体系中加入少量CuSO4固体后,c(Cu2+)减小,c(Mn2+)变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com