
设nA为阿伏加德罗常数,下列说法正确的是
A.常温下,28g C2H4含nA个碳碳双键
B.1 mol Cu和足量稀硝酸反应生成nA NO分子
C.常温常压下,22.4L CCl4含有n A个CCl4分子
D.1mol/L NaCl溶液含有n A个Na+
科目:高中化学 来源:2014-2015湖北宜昌市高二3月月考化学试卷(解析版) 题型:填空题
(12分)(1)已知反应Ⅰ:4NH3(g)+3O2(g)==2N2(g)+6H2O(g) △H=-1266.8kJ/mol
反应Ⅱ:N2(g) + O2(g)== 2NO(g) △=+180.5kJ/mol
它们的平衡常数依次为K1、K2
①写出氨高温催化氧化生成NO的热化学方程式 ,该反应的化学平衡常数的表达式K= (用含K1、K2的代数式表示)。
②反应Ⅰ可设计成燃料电池,若该电池以KOH溶液作电解质溶液,则负极的电极反应式为: 。该电池使用过程中,正极附近溶液的pH将 (填“升高”、“降低”或“不变”)。
(2)已知:N2(g) +3H2(g)  2NH3(g) △H=-92kJ/mol。
2NH3(g) △H=-92kJ/mol。
①为提高H2的转化率,宜采取的措施有 (填字母)
A.及时移出氨 B.升高温度
C.使用催化剂 D.循环利用和不断补充N2
②在一定温度、压强下,将N2和H2按体积比1:3在密闭容器中混合,当反应达平衡时,测得平衡混合气体中NH3的体积分数为25%,此时H2的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:填空题
(11分)工业上制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+ 12HF+ 3 A = 2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
(1)反应物A的化学式为 ,属于 晶体。
(2)生成物中由分子组成的物质属于极性分子的是 (写分子式),由分子组成的晶体中熔点较高的是 (写分子式),由分子组成的晶体中密度较大的是 (写分子式)
(3)反应物中有两种元素在元素周期表中位置相邻,请用一个化学方程式来表示它们的非金属性的大小 ,并请写出其中电负性较小的元素原子的价层电子排 布图: 。
(4)制取冰晶石(Na3AlF6)的化学方程式中除氢外,其余原子的第一电离能由大到小的顺序
(5)冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如图所示,●位于大立方体顶点和面心 ,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是 (填具体的微粒符号)。
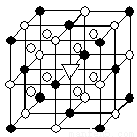
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:选择题
以下有关元素性质的说法不正确的是
A.具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是①
B.具有下列价电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,第一电离能最大的是③
C.①Na、K、Rb ②O、S、Se ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③
D.某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它 与氯气反应时可能生成的阳离子是X3+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省梅州市高三高三总复习质检理综化学试卷(解析版) 题型:选择题
(双选)短周期元素W、X、Y、Z在元素周期表中的相对位置如下图所示,其中Y所处的周期序数与族序数相等。W最外层电子数是内层电子数的3倍。下列说法正确的是
… | W | |||
X | Y | … | Z |
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的稳定性小于Z的气态氢化物的稳定性
D.W与Y形成的化合物可分别与NaOH溶液和盐酸反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:填空题
选做(15分)【化学选修2:化学与技术】
硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:
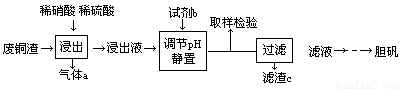
(1)“浸出”时,原料中的铜均转化为硫酸铜。写出相应的化学方程式: 。
(2)试剂b是 (填物质名称),其反应的离子方程式: 。
(3)调节pH的目的是 。滤渣c是 。
(4)在农业上,将胆矾、生石灰和水按一定比例混合制成波尔多液,其反应的化学方程式为 。
(5)气体a可以被循环利用,用化学方程式表示其被循环利用的原理为: 。
(6)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,写出硫酸铜受热分解的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:选择题
已知平衡:①C2H4(g)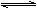 C2H2(g)+H2(g),②2CH4(g)
C2H2(g)+H2(g),②2CH4(g)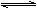 C2H4(g)+2H2(g)。当升高温度时,①和②式皆向右移动。
C2H4(g)+2H2(g)。当升高温度时,①和②式皆向右移动。
(1)C(s)+2H2(g)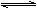 CH4(g)
CH4(g) 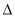 H1
H1
(2)2C(s)+H2(g)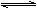 C2H2(g)
C2H2(g) 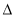 H2
H2
(3)2C(s)+2H2(g)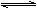 C2H4(g)
C2H4(g) 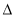 H3
H3
下列有关(1)、(2)和(3)中的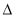 H1、
H1、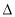 H2、
H2、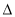 H3大小顺序排列正确的是
H3大小顺序排列正确的是
A.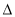 H1>
H1>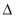 H2>
H2> H3 B.
H3 B.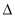 H2>
H2>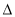 H3>2
H3>2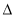 H1
H1
C.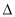 H2>
H2>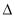 H1>
H1>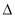 H3 D.
H3 D.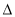 H3>
H3>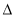 H2>2
H2>2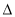 H1
H1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高三下学期第一次模考化学试卷(解析版) 题型:实验题
(14分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
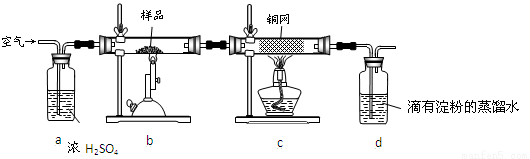
现称取研细的黄铜矿样品1.84 g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的 置于锥形瓶中,用0.05 mol/L标准碘溶液进行滴定,消耗标准溶液20 mL。请回答下列问题:
置于锥形瓶中,用0.05 mol/L标准碘溶液进行滴定,消耗标准溶液20 mL。请回答下列问题:
(1)将样品研细后再反应,其目的是 。
(2)装置a和c的作用分别是_ ___和__ __(填标号,可以多选)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是 。
(4)通过计算可知,该黄铜矿的纯度为 。
(5)若用下图装置替代上述实验装置d,同样可以达到实验目的的是 (填序号)。
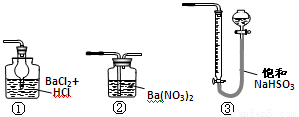
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度会产生误差,假设实验操作均正确,可能的原因主要有_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市门头沟区高三3月综合练习理综化学试卷(解析版) 题型:选择题
甲、乙、丙三种有机物的结构简式如下图所示,下列说法不正确的是
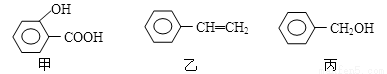
A.甲、乙、丙都能发生加成反应、取代反应
B.丙与C6H5OH都含有-OH,质谱图显示的质荷比最大值相差14,但不属于同系物
C.淀粉、油脂、有机玻璃等都属于高分子化合物
D.乙的化学名称为苯乙烯,能使溴水褪色,但不存在顺反异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com