
Ⅰ、有下列五种烃:① 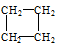 ②
② 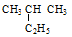 ③乙烷 ④戊烷 ⑤
③乙烷 ④戊烷 ⑤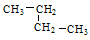 ,其中互为同分异构体的是 (填序号),②与⑤之间的关系为 ,
,其中互为同分异构体的是 (填序号),②与⑤之间的关系为 ,
② ③ ④ ⑤四种物质按它们的沸点由高到低的顺序排列正确的是 (填序号)
Ⅱ、某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
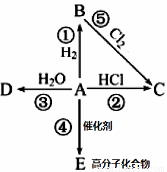
(1)写出A的电子式 ,E的结构简式为
(2)写出下列反应化学方程式,并注明③⑤反应类型
② _____________________________________________
③ _____________________ ,反应类型________;
⑤ _____________________ ,反应类型________;
(3)除去B中混有的少量杂质A,所用的试剂为
I ②④ 同系物 ④②⑤③
II.(1)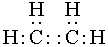
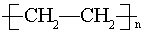
(2)②CH2=CH2+HCl 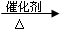 CH3CH2Cl
CH3CH2Cl
③CH2=CH2+H2O  CH3CH2OH 加成反应
CH3CH2OH 加成反应
⑤CH3CH3+Cl2 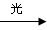 CH3CH2Cl+HCl 取代反应
CH3CH2Cl+HCl 取代反应
(3) 溴水
【解析】
试题分析:Ⅰ、②④分子式相同,结构不同,属于同分异构体;有下列五种烃:②与⑤结构相似,相差CH2,二者关系为同系物;烷烃碳原子数越多,沸点越高,相同碳原子数的烷烃,支链越多,沸点越低,故四种物质的沸点由高到低的顺序为④②⑤③;
Ⅱ、某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,故为乙烯,根据转化关系知:B为乙烷,C为氯乙烷,D为乙醇,E为聚乙烯;除去乙烷中混有的少量杂质乙烯,可以选用溴水。
考点:考查同系物、同分异构体、有机物的推断等相关知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014天津市红桥区高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
已知NA代表阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4 L O2和O3组成的混合物中原子总数为2NA
B.1 mol铁铝混合物与足量稀盐酸反应时,转移电子数是3NA
C.在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
D.1 mol重甲基(-CD3)含有电子数为9NA
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河东区高三二模考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.某粒子的电子数等于质子数,则该粒子可能是一种分子或一种离子
B.构成单质的分子中一定含有共价键
C.溶液和胶体的本质区别是有无丁达尔效应
D.化学变化不产生新元素,产生新元素的变化不是化学变化
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高三第五次月考理综化学试卷(解析版) 题型:填空题
(14分)Q、W、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。W原子最外层电子数与核外电子总数之比为3∶4,Q、Y的氧化物是导致酸雨的主要物质,X是地壳中含量最高的金属元素,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。以下问题均有化学用语回答
 (1)Q单质的电子式为_______。
(1)Q单质的电子式为_______。 W、X、Y的离子半径由大到小的顺序为____(用离子符号回答)。
W、X、Y的离子半径由大到小的顺序为____(用离子符号回答)。
 (2)X和Y组成的化合物放入水中反应的化学方程式是______________________________。
(2)X和Y组成的化合物放入水中反应的化学方程式是______________________________。
(3)Na2Y溶液中离子浓度由大到小的顺序为____________________________________________。
 (4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式____________。
(4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式____________。
(5)ZCl2溶液中混有FeCl3杂质时,可加入_____________(填试剂)调节pH=_________,再过滤。已知:Fe(OH)3的Ksp=10-35 ,化学上认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。
(6)工业上可用高温条件下Z2Y + O2=2Z + YO2来冶炼金属Z,生成1molZ时转移____mol电子。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市第二学期期中检测高一化学试卷(解析版) 题型:填空题
(1)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+ 2H2O(g)  CO2(g)+4H2(g)
CO2(g)+4H2(g)
反应过程中能量变化如图所示,
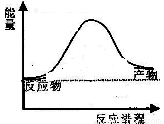
则该反应为 反应(填“吸热”或“放热”)
若已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |
则该反应吸收或放出热量为 kJ(用含a b c d字母的代数式表示)
(2)某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生
CH4(g)+ 2H2O(g)  CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
则 ① 前4s以H2O(g)浓度变化表示的平均反应速率为多少?② 4s时,混合气体中H2的体积分数为多少?③ 平衡时,CH4的浓度是多少?
(要求:写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市第二学期期中检测高一化学试卷(解析版) 题型:选择题
一定温度和一定体积的密闭容器中发生如下反应:A2(s)+ B2(g)  2AB(g) ,反应达到平衡状态的标志是
2AB(g) ,反应达到平衡状态的标志是
A.V正(B2)==2V逆(AB) B.单位时间内生成2molAB的同时消耗1mol的B2
C.容器内的总压强不随时间而变化 D.气体密度不再随时间变化而变化
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市第二学期期中检测高一化学试卷(解析版) 题型:选择题
科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:
NaHCO3+H2  HCOONa+H2O下列有关说法正确的是
HCOONa+H2O下列有关说法正确的是
A.储氢、释氢过程均无能量变化 B.储氢过程中,NaHCO3被氧化
C.NaHCO3含有离子键和共价键 D.释氢过程中,每消耗0.1molH2O放出2.24L的H2
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市下学期期中考试高二化学试卷(解析版) 题型:填空题
(1)一定条件下某烃与H2按物质的量之比1:2加成生成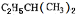 ,则该烃的结构简式为______________________________;
,则该烃的结构简式为______________________________;
(2)某有机物X分子中只含C、H、O三种元素,相对分子质量小于110,其中氧元素的质量分数为14.8%,已知该物质可与FeCl3溶液发生显色反应,则X的分子式为__________。
若1 mol X与浓溴水反应时消耗了3 mol Br2,则X的结构简式为____________________。
(3)分子式为C4H8的烃,核磁共振氢谱图中有两个吸收峰,峰面积比为3:1,请写出符合条件的所有物质的结构简式
(4)下列括号内为杂质,将除去下列各组混合物中杂质所需的试剂和方法填写在横线上。
① 溴乙烷(乙醇)____________________________________________________________
② 苯酚(苯)______________________________________________________________________
写出②操作中涉及到的反应的化学方程式________________________________________
(5)已知: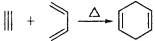 ,如果要合成
,如果要合成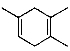 所用的原始原料可以是( )
所用的原始原料可以是( )
A.2-甲基-l,3-丁二烯和2-丁炔 B.2,3-二甲基-1,3-戊二烯和乙炔
C.2,3-二甲基-l,3-丁二烯和丙炔 D.1,3-戊二烯和2-丁炔
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市南开区高三二模试卷理综化学试卷(解析版) 题型:推断题
(18分)有机物F是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去)。请回答下列问题:

(1)B的结构简式是_______;E中含有的官能团名称是_______。
(2)由C和E合成F的化学方程式是____________________________ 。
(3)同时满足下列条件的苯的同分异构体的结构简式是______________。
①含有3个双键;②核磁共振氢谱只显示1个吸收峰;③不存在甲基
(4)乙烯在实验室可由_______(填有机物名称)通过_______(填反应类型)制备,制乙烯时还产生少量SO2、CO2及水蒸气,用以下试剂检验这四种气体,混合气体通过试剂的顺序是________。(填序号)。
①饱和Na2SO3溶液②酸性KMnO4溶液③石灰水④无水CuSO4⑤品红溶液
(5)下列说法正确的是_______(填序号)。
a.A属于饱和烃 b.D与乙醛的分子式相同
c.E不能与盐酸反应 d.F可以发生酯化反应
(6)以乙烯为原料可合成乙二酸二乙酯(CH3CH2OOC-COOCH2CH3),请在方框内写出合成路线流程(无机试剂任选)。注:合成路线流程的书写格式参照如下示例:CH4 CH3Cl
CH3Cl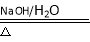 CH3OH
CH3OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com