
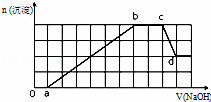
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是()
A. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
B. ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓
C. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+、Na+
D. d点溶液中含有的溶质只有Na2SO4
考点: 常见阳离子的检验;离子共存问题.
专题: 离子反应专题.
分析: 加入氢氧化钠溶液后,在0﹣a段没有生成沉淀,说明溶液中一定存在氢离子或碳酸氢根离子,由于后面有沉淀生成及部分沉淀溶解可知,一定存在氢离子;a﹣b段生成沉淀消耗了6a体积氢氧化钠,溶液中可能存在Mg2+、Fe3+、Al3+,根据c﹣d段部分沉淀溶解,可知一定存在铝离子,根据图象Al(OH)3的物质的量与剩余的沉淀的物质的量相等,由OH﹣~AlO2﹣可知消耗溶解氢氧化铝消耗了1体积氢氧化钠,所以生成氢氧化铝沉淀消耗了3体积氢氧化钠,另一种离子生成的沉淀的量与消耗的氢氧化钠与铝离子相同,说明另一种离子为3价离子,则为铁离子;
b﹣c段沉淀的物质的量不变,说明氢氧根离子与铵离子发生了反应,即溶液中一定存在铵离子;
A、根据以上分析判断溶液中一定存在的离子、铁离子与铝离子物质的量之比;
B、ab段为铁离子、铝离子与氢氧化钠反应生成氢氧化铁、氢氧化铝沉淀;
C、根据分析判断溶液中一定不存在镁离子,一定存在铁离子,钠离子无法确定;
D、d点氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠.
解答: 解:加入0﹣a段,加入氢氧化钠溶液后没有生成沉淀,说明溶液中一定存在氢离子或碳酸氢根离子,由于后面有沉淀生成及部分沉淀溶解可知,溶液中一定存在铝离子,所以一定不存在碳酸氢根离子,因此一定存在氢离子;
a﹣b段生成沉淀消耗了6体积氢氧化钠,溶液中可能存在Mg2+、Fe3+、Al3+,根据c﹣d段部分沉淀溶解,可知一定存在Al3+,根据图象氢氧化铝沉淀的物质的量与剩余的沉淀的物质的量相等,由OH﹣~AlO2﹣可知消耗溶解氢氧化铝消耗了a体积氢氧化钠,所以生成氢氧化铝沉淀消耗了3体积氢氧化钠,另一种离子生成的沉淀的量与消耗的氢氧化钠与铝离子相同,说明另一种离子为+3价离子,只能为铁离子,故原溶液中一定不存在镁离子;
再由b﹣c段沉淀的物质的量不变,说明氢氧根离子与铵离子发生了反应,即溶液中一定存在铵离子;
再根据溶液呈电中性可知,溶液中一定存在硫酸根离子,
A、根据图象可知生成沉淀用了6体积的氢氧化钠,其中氢氧化铝溶解消耗了1体积的氢氧化钠,所以生成氢氧化铝需要消耗3体积的NaOH溶液,还有3体积的NaOH溶液一定是被Fe3+消耗,即铁离子与铝离子消耗的氢氧化钠溶液的体积相同,故原溶液中含有的Fe3+和Al3+的物质的量之比为1:1,故A正确;
B、根据以上分析可知,ab段发生的离子反应为铁离子、铝离子与氢氧根离子的反应,反应的离子方程式为:Al3++3OH﹣=Al(OH)3↓,Fe3++3OH﹣=Fe(OH)3↓,故B错误;
C、原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+,一定不存在镁离子,可能存在钠离子,故C错误;
D、d点氢氧化铝与氢氧化钠溶液恰好完全反应生成偏铝酸钠,所以溶液中含有的溶质为Na2SO4、NaAlO2,故D错误;
故选A.
点评: 本题考查了离子检验的方法应用,题目难度中等,氢氧化铝是两性氢氧化物溶于强碱是解题关键,本题难点在于如何根据图象中的数据判断铁离子的存在.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知在1.01×105 Pa、298K条件下,2mol H2燃烧生成水蒸气时放出484kJ热量.下列热化学方程式中正确的是()
A. H2O(g)═H2(g)+ O2(g)△H=+242 kJ•mol﹣1
O2(g)△H=+242 kJ•mol﹣1
B. 2H2(g)+O2(g)=2H2O(l)△H=﹣484 kJ•mol﹣1
C. H2O(g)+ O2(g)=H2O(g)△H=+242 kJ•mol﹣1
O2(g)=H2O(g)△H=+242 kJ•mol﹣1
D. 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
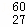 Co是γ放射源,
Co是γ放射源,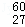 Co可用于农作物的诱变育种,我国用该方法培育出了许多农作物新品种.对
Co可用于农作物的诱变育种,我国用该方法培育出了许多农作物新品种.对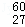 Co原子的叙述不正确的是()
Co原子的叙述不正确的是()
A. 质量数是60 B. 质子数是60 C. 中子数是33 D. 电子数是27
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)()
A. 
用装置甲检验溶液中是否有K+
B. 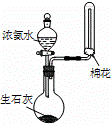
用装置乙制取并收集少量NH3
C. 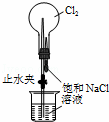
用装置丙进行喷泉实验
D. 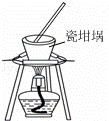
用装置丁加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
有关下列实验操作和相应的离子方程式的说法正确的是()
A. 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH﹣+H+=Mg(OH)2↓+H2O
B. Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3﹣+OH﹣=CaCO3↓+2H2O
C. 等物质的量的FeBr2与Cl2反应为:2Fe2++2Br﹣+2Cl2=2Fe3++Br2+4Cl﹣
D. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4﹣+6H++5H2O2=2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
硝铝[Al(NO3)3]是一种常用媒染剂.工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3•9H2O]的流程如图甲:
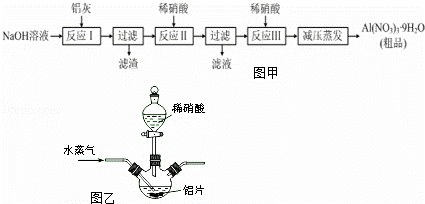
(1)写出反应Ⅰ的离子方程式: )(任写一个).
(2)若在实验室中完成反应Ⅱ,为避免铝的损失,需要解决的问题是),可采取的措施为
(3)上述流程中采用减压蒸发,并控制反应Ⅲ中加入的稀硝酸稍过量,其目的是.
(4)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4:1),该反应的化学方程式是.
(5)若用图乙所示实验装置制取Al(NO3)3,通入水蒸气的作用是.
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是一套实验室制气装置,用于发生、干燥和收集气体. 下列各组物质中能利用这套装置进行实验的是()

A. 铜屑和浓硝酸 B. 二氧化锰和浓盐酸
C. 锌和稀硫酸 D. 碳酸钙和稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
当铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率增大的是()
A. 不用稀硫酸,改用98%的浓硫酸
B. 加热
C. 适当增大稀硫酸的浓度
D. 不用铁片,改用铁粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com