
| A. | 加热NH4Cl只破坏离子键 | |
| B. | N2H4中极性键与非极性键的比值是1:4 | |
| C. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| D. | 某元素最高价氧化物的水化物和氢化物的化学式分别为H2XO4、H2X |
分析 A、NH4Cl受热分解既发生离子键破坏,又发生共价键破坏;
B、N2H4 中含有4个N-H键和1个N-N键,N原子上含有一个孤电子对;
C、PCl3分子中所有原子的最外层都达到8电子稳定结构;BCl3分子中B原子的最外层电子数为6;
D、元素X的最高价氧化物的水化物的化学式为H2XO4,所以X的最高正价是+6价,元素的最高正价+|最低负价|=8,所以最低负价为-2价,由此书写X的气态氢化物.
解答 解:A、NH4Cl受热分解既发生离子键破坏,又发生共价键破坏,而不是仅仅破坏离子键,故A错误;
B、N2H4 中含有4个N-H键和1个N-N键,N原子上含有一个孤电子对,所以2H4中极性键与非极性键的比值是4:1,故B错误;
C、PCl3分子中所有原子的最外层都达到8电子稳定结构;BCl3分子中B原子的最外层电子数为6,而不是达到8电子稳定结构,故C错误;
D、元素X的最高价氧化物的水化物的化学式为H2XO4,所以X的最高正价是+6价,元素的最高正价+|最低负价|=8,所以最低负价为-2价,X的气态氢化物的化学式为H2X,故D正确;
故选D.
点评 本题考查化学键、化学键的类型、核外电子排布、以及元素周期律的应用知识,注意把握元素的最高正价与负价的关系,题目较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 高纯度的硅广泛用于制作光导纤维,其遇强碱会“断路” | |
| B. | 焰火的五彩缤纷是某些金属元素物理性质的展现 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| D. | 食盐、次氯酸钠溶液均可以将某些病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的电子层数比Y原子的电子层数多 | |
| B. | Y的最高价氧化物对应的水化物酸性比X的最高价氧化物对应的水化物强 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能将X从KX的溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
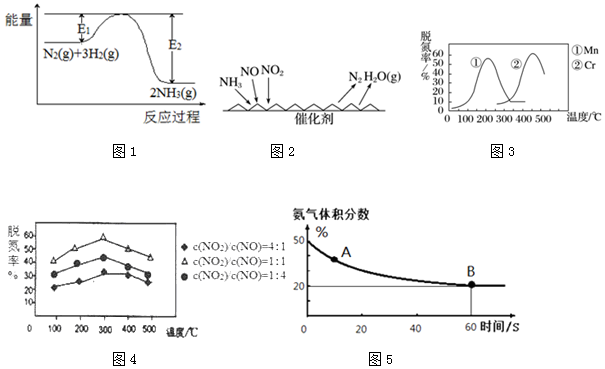
 利用氨气脱硝(除NO)是大气污染防治研究的热点,脱硝过程中涉及的反应为:
利用氨气脱硝(除NO)是大气污染防治研究的热点,脱硝过程中涉及的反应为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )
常温下饱和CO2溶液的pH约为5.6.向某未知浓度的Na2CO3溶液中滴入已知浓度的盐酸时,用 pH传感器测得混合溶液的pH变化曲线如图所示,下列说法正确的是( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | 在pH=7时,c(Na+)>c(Cl-) | |
| C. | 在pH=6时,c(Na+)>c(CO32-)>c(HCO3-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图一:引发铝热反应的操作是点燃镁条 | |
| B. | 图二:可用于化学反应速率的测定 | |
| C. | 图三:滴加K3[Fe(CN)6]溶液,产生特征蓝色沉淀 | |
| D. | 图四:酸式滴定管注入Na2CO3溶液之前应检查是否漏液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:
已知:
 .
. ;H的顺式结构简式为
;H的顺式结构简式为 .
. (任写一种).
(任写一种).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃料不完全燃烧排放的CO是大气污染物之一 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 将已成熟的水果放入未成熟的水果中并密封,可加速水果成熟 | |
| D. | 医用消毒酒精中乙醇的浓度(体积分数)为95% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com