
【题目】550℃时,有如下反应:2SO2+O2![]() 2SO3 ΔH<0。把2molSO2和1molO2放入恒容的密闭容器中,判断该反应达到平衡状态的标志是( )
2SO3 ΔH<0。把2molSO2和1molO2放入恒容的密闭容器中,判断该反应达到平衡状态的标志是( )
A. SO2和SO3浓度相等
B. 单位时间内反应掉0.2molSO2的同时生成了0.2molSO3
C. 容器中气体的压强不变
D. 容器中混合气体的密度保持不变
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是
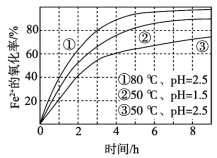
A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用无水乙酸钠和碱石灰混合制甲烷:CH3COONa+NaOH![]() CH4↑+Na2CO3,为了探究甲烷的化学性质,进行了以下实验,B装置中的试剂为溴水或酸性KMnO4溶液,一段时间后,无水硫酸铜变蓝,澄清石灰水变浑浊。所需装置如图(部分夹持仪器已略去):
CH4↑+Na2CO3,为了探究甲烷的化学性质,进行了以下实验,B装置中的试剂为溴水或酸性KMnO4溶液,一段时间后,无水硫酸铜变蓝,澄清石灰水变浑浊。所需装置如图(部分夹持仪器已略去):

(1)写出H装置中反应的离子方程式:______________________。
(2)C装置中的试剂为___________。
(3)实验测得消耗的CH4和CuO的质量比为1∶20,则D中硬质玻璃管内发生反应的化学方程式为______
(4)实验开始前,先在G装置的大试管上套上黑色纸套,反应结束后,取下黑色纸套,使收集满气体的试管置于光亮处缓慢反应一段时间,观察到的现象有:
①试管中有少量白雾;
②导管内液面上升
③_______
④_______
(5)有关该实验的说法,正确的是______(填字母)。
A.若B装置中的试剂是溴水,溴水无明显变化,说明CH4不能与卤素单质反应
B.若B中是酸性高锰酸钾溶液,溶液无明显变化,说明通常情况下甲烷难以被强氧化剂氧化
C.硬质玻璃管中的黑色固体粉末变红,说明甲烷具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)将等质量的镁分别与足量的CO2、O2、N2、空气中充分燃烧,反应前后固体增重由大到小的顺序为___。
(2)在常温下,实验室用固体亚硫酸钠和中等浓度的硫酸制取SO2气体。将制得的SO2气体通入紫色石蕊试液,可观察到的现象为___。
(3)在常温下,把NO气体压缩到1.01×108Pa,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力![]() 就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式___。
就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式___。
(4)按如图进行实验,试管中装有NO,然后缓慢地通入84mLO2,充分反应后液面高度不变,则原试管中装有NO的体积为___。
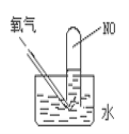
(5)标况下,将一定体积的盛满NO、NO2、O2的混合气体的试管倒立于水槽中,水充满整个试管,则试管内的溶液的物质的量浓度范围是(假定试管内溶液不扩散)为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列粒子的描述不正确的是( )
A. PH3的电子式为![]() ,其热稳定性不如NH3
,其热稳定性不如NH3
B. HS-的电子式为![]() ,是含有极性键的18电子的粒子
,是含有极性键的18电子的粒子
C. CH2Cl2的电子式为![]() ,是结构呈正四面体的分子
,是结构呈正四面体的分子
D. KF的电子式为![]() ,它是易溶于水的离子化合物
,它是易溶于水的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案能达到实验目的的是(部分夹持装置已略去)
|
|
|
|
A证明醋酸酸性比 硼酸强 | B实验室制 氢氧化亚铁 | C实验室制氨气 | D证明碳酸氢钠热稳定 性比碳酸钠弱 |
A.AB.B…C.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期律回答下列问题:
(1)B(硼元素)在元素周期表中与![]() 同主族,已知:
同主族,已知:![]() ,则
,则![]() 的电离方程式为___________________________________。酸性:
的电离方程式为___________________________________。酸性:![]() __________
__________![]() (填“>”或“<”)
(填“>”或“<”)
(2)![]() 和镁粉混合点燃可得单质B,该反应的化学方程式为_________________。
和镁粉混合点燃可得单质B,该反应的化学方程式为_________________。
(3)![]() 可用于生产储氢材料
可用于生产储氢材料![]() 。
。![]() 具有强还原性。在碱性条件下,
具有强还原性。在碱性条件下,![]() 与
与![]() 溶液反应可得
溶液反应可得![]() 和
和![]() ,其中H元素由
,其中H元素由![]() 价升高为
价升高为![]() 价。
价。
①写出基态![]() 核外电子排布式______________;
核外电子排布式______________;![]() 基态核外电子排布图_________________
基态核外电子排布图_________________
②基态B原子中能量最高的是__________电子,其电子云在空间呈现____________形
③写出碱性条件下,![]() 与
与![]() 溶液反应的离子方程式:__________________
溶液反应的离子方程式:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】优化反应条件是研究化学反应的重要方向。
(1)以硫代硫酸钠与硫酸的反应Na2S2O3 + H2SO4= Na2SO4 + SO2+ S↓ + H2O为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
实验 序号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 温度/℃ | ||
浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | ||
I | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
II | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
III | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
①表中,a为________________________,b为________________。
②实验表明,实验III的反应速率最快,支持这一结论的实验现象为_________________________。
(2)硫代硫酸钠可用于从含氧化银的矿渣中浸出银,反应如下:Ag2O + 4S2O32- + H2O ![]() 2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因________
2[Ag(S2O3)2]3- + 2OH-,实际生产中,为了提高银的浸出率需要调节pH的范围为8.5~9.5,解释其原因________
(3)工业上常用空气催化氧化法除去电石渣浆(含CaO)上清液中的S2-,并制取石膏(CaSO4·2H2O),其中的物质转化过程如下图所示。
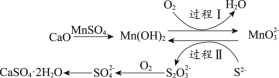
①过程I、II中,起催化剂作用的物质是_______________。
②过程II中,反应的离子方程式为_________。
③根据物质转化过程,若将10 L上清液中的S2-转化为SO42-(S2-浓度为320 mg/L),理论上共需要标准状况下的O2的体积为___________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家的研究成果往往对人类社会的进步产生重大影响,下列对应关系错误的是( )
A.舍勒首先在实验室制得了氯气
B.氧气是戴维通过实验首先发现的
C.门捷列夫绘制了第一张元素周期表
D.侯德榜研究并使纯碱的生产实现了国产化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com