
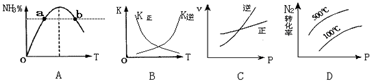
分析 (1)反应热=反应物总键能-生成物总键能,注明物质的聚集状态与反应热书写热化学方程式;正极发生还原反应,N2放电生成2NH4+,以此书写电极反应式;
(2)B、根据合成氨为放热反应,升高温度,平衡逆向移动判断;
C、根据合成氨为气体体积减小的反应,升高压强,正逆反应速率都增大,平衡正向移动判断;
D、根据合成氨为气体体积减小的放热反应,采用定一议二法判断;
根据v=$\frac{△c}{△t}$计算0~2min内氮气的反应速率,k=$\frac{c(N{\;}_{2})c(H{\;}_{2}){\;}^{3}}{c(NH{\;}_{3}){\;}^{2}}$计算2NH3(g)?N2(g)+3H2(g)的平衡常数;根据a、b两点氨气的百分含量相同说明a、b两点状态一样判断;
(3)根据CH3COOH和NH3•H2O的电离平衡常数分别为Ka(CH3COOH)=1.7×10-5 mol•L-1,Kb(NH3•H2O)=1.7×10-5 mol•L-1,说明电离程度一样,则25℃下1mol•L-1的醋酸溶液和1mol•L-1的氨水,且知醋酸溶液的pH=a,则电离出的氢离子浓度为10-amol/L,同条件下,氨水电离出的氢氧根离子浓度也为10-amol/L,据此计算;根据Qc>Ksp时开始沉淀计算判断.
解答 解:(1)反应发生:N2(g)+3H2(g)?2NH3(g),则△H=945KJ•mol-1+3×436KJ•mol-1-6×391KJ•mol-1=-93 KJ•mol-1,反应热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-93 KJ•mol-1;总的反应氮气与氢在氯化氢氛围生成氯化铵,所以总的电池反应式为:N2+3H2+2HCl=2NH4Cl,正极发生还原反应,N2放电生成2NH4+,正极电极反应式为N2+6e-+8H+=2NH4+;
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-93 KJ•mol-1;N2+6e-+8H+=2NH4+;
(2)B、因为合成氨为放热反应,升高温度,平衡逆向移动,所以K正减小,K逆增大,故B正确;
C、因为合成氨为气体体积减小的反应,升高压强,正逆反应速率都增大,平衡正向移动,所以正反应速率增大的比逆反应多,故C错误;
D、因为合成氨为气体体积减小的放热反应,所以同温下,压强越大越向正反应方向移动,则氮气的转化率越大;同压下,温度越大越向逆反应方向移动,则氮气的转化率越小,故D错误;
N2(g)+3H2(g)?2NH3(g)设2min氮气消耗xmol,则
开始 0.6 1.6 0
2min x 3x 2x
平衡0.6-x 1.6-3x 2x
所以 $\frac{2x}{0.6-x+1.6-3x+2x}$=$\frac{4}{7}$,解得x=0.4
则0~2min内氮气的反应速率v=$\frac{△c}{△t}$=$\frac{\frac{0.4}{2}}{2}$=0.1mol•(L•min)-1;
2NH3(g)?N2(g)+3H2(g)的平衡常数k=$\frac{c(N{\;}_{2})c(H{\;}_{2}){\;}^{3}}{c(NH{\;}_{3}){\;}^{2}}$=$\frac{\frac{0.2}{2}×(\frac{0.4}{2}){\;}^{3}}{(\frac{0.8}{2}){\;}^{2}}$=0.005;
因为a、b两点氨气的百分含量相同,所以a、b两点状态一样,则a、b两点H2的转化率大小关系为a=b;
故答案为:B;0.1mol•(L•min)-1;0.005;=;
(3)因为CH3COOH和NH3•H2O的电离平衡常数分别为Ka(CH3COOH)=1.7×10-5 mol•L-1,Kb(NH3•H2O)=1.7×10-5 mol•L-1,说明电离程度一样,则25℃下1mol•L-1的醋酸溶液和1mol•L-1的氨水,且知醋酸溶液的pH=a,则电离出的氢离子浓度为10-amol/L,同条件下,氨水电离出的氢氧根离子浓度也为10-amol/L,所以氢离子浓度为10a-14mol/L,则pH=14-a;
向各含有0.1mol的MgCl2和CuCl2混合溶液中逐滴加入氨水,当滴至混合液的体积为1L时,混合液的pH为9,所以Qc(Mg(OH)2)=0.1×(10-5)2=10-11<Ksp[Mg(OH)2],则无Mg(OH)2沉淀;Qc(Cu(OH)2)=0.1×(10-5)2=10-11>Ksp[Cu(OH)2],则有Cu(OH)2沉淀;
故答案为:14-a;A.
点评 本题考查盖斯定律的应用,电极方程式的书写,以及电离平衡、溶度积、化学反应速率、平衡常数、化学平衡有关计算应用,难度中等,注意对知识的理解与掌握,是对学生能力的考查.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 5<pH<7.1 | B. | 7.1<pH<9 | C. | 3<pH<7.1 | D. | 7.1<pH<11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
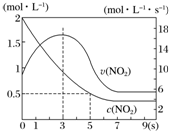 某绝热恒容容器中充入2mol•L-1 NO2,发生反应2NO2(g)═N2O4(g)△H=-56.9kJ•mol-1.下列分析不正确的是( )
某绝热恒容容器中充入2mol•L-1 NO2,发生反应2NO2(g)═N2O4(g)△H=-56.9kJ•mol-1.下列分析不正确的是( )| A. | 5s时NO2的转化率为75% | |
| B. | 0~3 s时v(NO2)增大是由于体系温度升高 | |
| C. | 3s时化学反应处于平衡状态 | |
| D. | 9s时再充入N2O4,平衡后K较第一次平衡时大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ/mol | 348 | 413 | 436 | 358 | x | 463 |
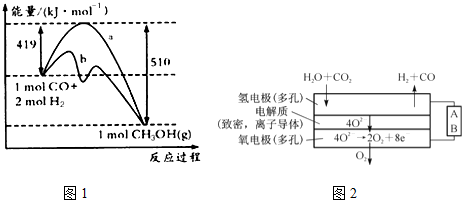
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol/L | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,92 g NO2和N2O4混合气体含有的原子数为6 NA | |
| B. | 5.6 g金属铁与足量稀盐酸反应,失去的电子数为0.3 NA | |
| C. | 标准状况下,ll.2 LSO3含有的分子数为0.5 NA | |
| D. | 25℃、101 kPa时,64 g SO2中含有的氧原子数为3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com