

 .
.分析 (1)根据题中反应原理,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,第二步是铁离子将二氧化硫氧化成硫酸根离子,根据电荷守恒和元素守恒可书写反应的离子方程式;
(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,若溶液的pH偏高,溶液碱性增强,铝离子与碳酸根离子双水解生成氢氧化铝和二氧化碳,根据元素守恒可书写反应的化学方程式;
(3)根据流程图可知道:食盐水在特定条件下电解得到氯酸钠(NaClO3),NaClO3和HCl反应,生成ClO2,可以写出方程式,并用化合价升降法配平得到,ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,应为二氧化碳和氮气,自身被还原成Cl-,根据电荷守恒和元素守恒写出该反应的离子方程式;
解答 解:(1)根据题中反应原理,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,第二步是铁离子将二氧化硫氧化成硫酸根离子,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO4 2-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO4 2-+4H+;
(2)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,若溶液的pH偏高,溶液碱性增强,铝离子与碳酸根离子双水解生成氢氧化铝和二氧化碳,反应的化学方程式为3CaCO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CaSO4↓+3CO2↑,
故答案为:3CaCO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CaSO4↓+3CO2↑;
(3)根据流程图可知道:食盐水在特定条件下电解得到氯酸钠(NaClO3),NaClO3和HCl反应,生成ClO2,可以写出方程式,并用化合价升降法配平得到,ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,应为二氧化碳和氮气,自身被还原成Cl-,根据电荷守恒和元素守恒写出该反应的离子方程式,
①电解食盐水得到氯酸钠(NaClO3)和H2,电解的离子反应方程式为:Cl-+3H2O$\frac{\underline{\;电解\;}}{\;}$ClO3-+3H2↑,故答案为:Cl-+3H2O$\frac{\underline{\;电解\;}}{\;}$ClO3-+3H2↑;
②ClO2发生器中的反应为,化学方程式NaClO3和盐酸发生歧化反应,生成NaCl、ClO2、Cl2、H2O,用化学方程式表示并标出电子转移的方向及数目为 ,
,
故答案为: ;
;
③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,应为二氧化碳和氮气,自身被还原成Cl-,反应的离子方程式为 2ClO2+2CN-=2CO2↑+2Cl-+N2↑,
故答案为:2ClO2+2CN-=2CO2↑+2Cl-+N2↑.
点评 本题通过化学工艺流程,考查了氧化还原反应相关概念、配平及计算,电解原理,综合性强,题目难度中等,对于该类题目的处理,注意看清工艺流程的目的,分析工艺流程的过程,寻找与所学知识的结合点.


科目:高中化学 来源: 题型:选择题
| A. | 实验过程中使用四氯化碳时戴防尘口罩 | |
| B. | 实验过程中移取强酸、强碱溶液应带防酸碱手套 | |
| C. | 实验场所严禁携带食物;禁止用饮料瓶装化学药品,防止误食 | |
| D. | 称取粉末状的有毒药品时,要带口罩防止吸入 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
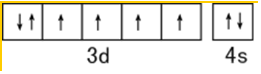 .
.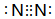 .
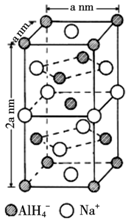
.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | |
| B. | 向某溶液中滴加硝酸酸化的BaCl2溶液产生白色沉淀,则该溶液中含有SO42- | |
| C. | 在电解精炼铜过程中,阳极质量的减少多于阴极质量的增加 | |
| D. | 298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急.
将不可再生的天然气、石油、煤等化石燃料转化利用、变废为宝已成为当务之急.| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+0.45Fe3+0.50O | B. | Fe2+0.85Fe 3+0.10O | ||
| C. | Fe2+0.15Fe3+0.80O | D. | Fe2+0.20Fe 3+0.75O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
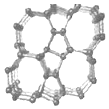
| A. | Si24是一种新型化合物 | |
| B. | Si24是硅的一种同素异形体 | |
| C. | Si24易与稀硫酸反应生成氢气 | |
| D. | 硅太阳能电池供电原理与原电池相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com