
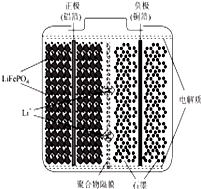
 锂离子电池广泛应用与日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新呈”.
锂离子电池广泛应用与日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新呈”.分析 (1)①根据原子守恒分析;
②C2O42-中C的化合价为+3价,生成CO和CO2,C元素的化合价分别为+2价、+3价,根据电子与LiFePO4的关系计算;
③亚铁离子容易被氧气氧化;
(2)放电时,Li1-xFePO4在正极上得电子发生氧化反应;充电时,阳离子向阴极移动;电解质为锂盐,锂离子通过交换膜向正极移动;
(3)电解精炼铜得到铜0.32g时,电解消耗的电量Q=znF,根据放电的电流强度I=2.0A,电池工作10分钟,可计算得电池的输出电量,根据电流利用效率=$\frac{负载利用电量}{电池输出电量}$,可计算出电流利用率;
(4)LiFePO4中亚铁离子在酸性条件下,被双氧水氧化为铁离子.
解答 解:(1)①由原子守恒可知,Li2CO3+2FeC2O4•2H2O+2NH4H2PO4═2LiFePO4+2NH3↑+3CO2↑+2CO↑+7H2O↑,
故答案为:2LiFePO4;2CO↑;7H2O↑;
②C2O42-中C的化合价为+3价,生成CO和CO2,C元素的化合价分别为+2价、+3价,生成2molCO转移2mol电子,同时生成2molLiFePO4,则当反应中每转移0.15mol电子,生成0.15molLiFePO4,其质量为23.7g,
故答案为:23.7;
③亚铁离子容易被氧气氧化,所以要隔绝氧气,即反应需在惰性气氛的保护中进行,
故答案为:防止Fe(Ⅱ)被氧化;
(2)电池工作时的总反应为:LiFePO4+6C$?_{放电}^{充电}$Li1-xFePO4+LixC6,放电时,Li1-xFePO4在正极上得电子发生氧化反应,正极反应为Li1-xFePO4+xLi++xe-═LiFePO4;充电时,正极与外接电源的正极相连为阳极,阳离子向阴极移动,即Li+由左向右移动;电解质为锂盐,锂离子通过交换膜向正极移动,所以交换膜应该为阳离子交换膜,
故答案为:Li1-xFePO4+xLi++xe-═LiFePO4;由左向右;阳;
(3)LiFePO4+6C$?_{放电}^{充电}$Li1-xFePO4+LixC6,电解精炼铜得到铜0.32g时,即铜的物质的量为$\frac{0.32}{64}$=0.005mol,所以电解消耗的电量Q=2×0.005mol×96500C/mol=965C,根据放电的电流强度I=2.0A,电池工作10分钟,可计算得电池的输出电量Q=It=2.0×10×60=1200C,根据电流利用效率=$\frac{负载利用电量}{电池输出电量}$=$\frac{965}{1200}$×100%=80.4%,
故答案为:80.4%;
(4)LiFePO4中亚铁离子在酸性条件下,被双氧水氧化为铁离子,则发生反应的离子方程式为2LiFePO4+2H++H2O2═2Li++2Fe3++2PO43-+2H2O,
故答案为:2LiFePO4+2H++H2O2═2Li++2Fe3++2PO43-+2H2O.
点评 本题综合考查了物质的制备原理、原电池和电解池工作原理及相关计算,侧重于学生的分析能力和计算能力的考查,熟悉原电池、电解池工作原理及各个电极发生反应,难点是电流利用率的计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯中的甲苯(溴水) | B. | 乙醇中的水(新制CaO) | ||
| C. | 乙醛中的乙酸(NaOH) | D. | 乙酸乙酯中的乙酸(饱和NaHCO3溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
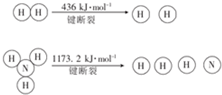
.
| n(N2)/mol | N(H2)/mol | N(NH3)/mol | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
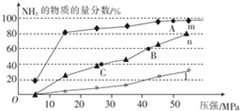
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 相对分子质量 | 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com