
科学家在研究化学物质时,常常对物质进行分类,以便对同类物质的组成和性能进行深入的研究。下列各组物质中有一种物质与其它物质不属于同一类,请将其挑出来,并说明理由。
| 物质组 | 不属于同类的物质 | 理由 |
| (1) Mg、O2 、N2、NO | ||
| (2) NaOH、Na2CO3、CH4、KCl | ||
| (3) H2CO3、H2SO4、NH3·H2O、H2SiO3 | ||
| (4) CaO、SO2 、CO2、SiO2 |
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
把河沙(主要成分是SiO2)跟镁粉按一定质量比(质量比大约为15∶24)混合均匀,装入试管中加热大约1 min后停止加热,发生剧烈反应,生成一种白色固体化合物和一种硅化物。待生成混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
(1)写出河沙与镁粉在加热条件下的化学方程式________________,该反应是________(填“放热”或“吸热”)反应。
(2)生成的混合物放入稀硫酸中,产生的气体是________(填化学式)。
(3)写出产生“爆炸声”的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的分子构型是三角锥形。以下关于PH3的叙述正确的是
A.PH3分子中有未成键的孤对电子 B.PH3是非极性分子
C.PH3是一种强氧化剂 D.PH3分子的P-H键是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
某离子晶体晶胞结构如下图所示,x位于立方体的顶点,Y位于立方体中心。试分析:
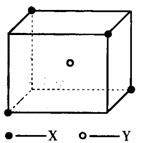 (1)晶体中每个Y同时吸引着__________个X,每个x同时
(1)晶体中每个Y同时吸引着__________个X,每个x同时
吸引着__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有
__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹∠XYX的
度数为__________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ·cm-3,阿伏加德罗常数为NA则晶体中两个距离最近的X中心间的距离为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是一种重要的金属资源,工业上制取镁单质主要是电解法。
(1)电解法制取镁单质的反应方程式是:______________________________。
(2)电解原料无水氯化镁可由海水制备。主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩冷却结晶。
其步骤先后顺序是__________________________________;(每步骤可重复使用)
(3)上述步骤①中“一定条件下”具体是指:_______________________________,其目的是___________________________________________。
(4)已知某温度下Mg(OH)2的Ksp=6.4×l0−12,当溶液中c(Mg2+)≤1.0×10−5mol·L−1可视为沉淀完全,则此温度下应保持溶液中c(OH-)≥_________________ mol·L−1。
(5)饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,看到的现象是___________。反应原理可能有两方面,请分别用离子方程式表示:
①________________________________________________;
②________________________________________________。
要验证①②谁是Mg(OH)2溶解的主要原因,可选取________代替NH4Cl溶液作对照实验。
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(6)镁电池是近年来科学技术研究的热点之一。一种“镁—次氯酸盐”电池的总反应为:
Mg + ClO- + H2O == Mg(OH)2 + Cl- 。其工作时正极的电极反应式:_________________;用此镁电池给铅蓄电池充电,下列说法中正确的是______________________________。
A.镁电池正极与铅蓄电池正极相连
B.电子从Pb电极转移到镁电池负极
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24 g Mg,阴、阳极的质量变化之比为3︰2
D.充电后,镁电池和铅蓄电池的pH均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com