
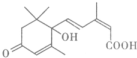
| A. | 其分子式为C15H22O4 | |
| B. | 1 mol该物质与足量NaOH溶液反应,最多消耗2 mol | |
| C. | 一定条件下,l mol该有机物最多可与4 mol氢气发生加成反应 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
分析 由结构简式可知分子式,分子中含碳碳双键、碳氧双键、-OH、-COOH,结合烯烃、醇、羧酸性质等来解答.
解答 解:A.由结构简式可知,该有机物的分子式为:C15H20O4,故A错误;
B.只有-COOH与NaOH反应,则1 mol该物质与足量NaOH溶液反应,最多消耗1 mol,故B错误;
C.碳碳双键、C=O双键与氢气发生加成反应,l mol该有机物最多可与4 mol氢气发生加成反应,故C正确;
D.不含酚-OH,不能与FeCl3溶液发生显色反应,故D错误.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握结构中官能团与性质的关系为解答的关键,侧重烯烃、羧酸、醇性质的考查,题目难度不大.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:填空题
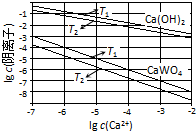 已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).
已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小.在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq).| 温度/℃ | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
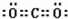 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某原子K层上只有一个电子 | |
| B. | 某离子L层和M层上的电子数均为K层的4倍 | |
| C. | 某离子M层上的电子数为L层上的4倍 | |
| D. | 某离子的核电荷数与最外层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
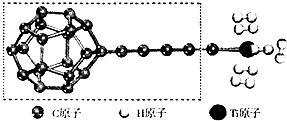 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
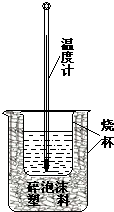 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子组成相同的化合物 | B. | 分子构造相同的化合物 | ||
| C. | 分子组成相同而构造不同的化合物 | D. | 分子组成与构造都不相同的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  石油蒸馏 | B. | 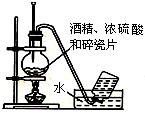 实验室用乙醇制取乙烯 | ||
| C. |  实验室制取乙酸乙酯 | D. |  证明酸性:盐酸>碳酸>苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2→H2SO4 | B. | Al(OH)3→Al2O3 | C. | SiO2→H2SiO3 | D. | Fe(OH)2→Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com