
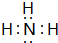 .
.分析 短周期的三种元素Z、X、Y,原子序数依次增大,原子核外电子层数之和是5,电子层数只能为1、2、2,则Z为H元素;X元素的最高化合价与最低价的代数和为零,处于IVA族,则X为C元素;Y元素原子最外电子层上的电子数是1+4=5,则Y为N元素.
解答 解:短周期的三种元素Z、X、Y,原子序数依次增大,原子核外电子层数之和是5,电子层数只能为1、2、2,则Z为H元素;X元素的最高化合价与最低价的代数和为零,处于IVA族,则X为C元素;Y元素原子最外电子层上的电子数是1+4=5,则Y为N元素.
(1)X元素的名称是碳,Y元素的名称是氮,Z元素的名称是氢,
故答案为:碳;氮;氢;
(2)X的氢化物的分子式是CH4,Y的氢化物为NH3,电子式是: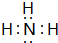 ,
,
故答案为:CH4;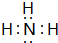 ;
;
(3)X、Y的含氧酸的分子式分别为H2CO3、HNO3,HNO3能与铜反应,反应的离子方程式为:3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O等,
故答案为:H2CO3;HNO3;3Cu+2NO3-+8H+=2NO↑+3Cu2++4H2O.
点评 本题考查结构性质位置关系应用,侧重于原子结构与元素化合物的结构和性质的考查,注意对基础知识的理解掌握.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
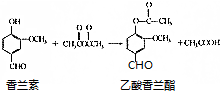
| A. | 该反应不属于取代反应 | |
| B. | 乙酸香兰酯的分子式为C10H8O4 | |
| C. | 香兰素与乙酸香兰酯都能与氢气发生加成反应 | |
| D. | 乙酸香兰酯在足量NaOH溶液中水解得到乙酸和香兰素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
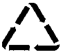
| A. | 大量燃烧化石燃料是造成雾霾天气的一种重要原因 | |
| B. | 含氟(CF2Cl2)制冷剂的使用是破坏臭氧层的原因之一 | |
| C. | 废旧金属应投入贴有如图所示标识的垃圾箱 | |
| D. | 夏天雷雨过后空气特别清新是因为空气中产生了少量二氧化氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
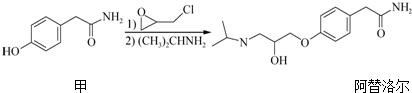
| A. | 化合物甲的分子式为C8H8O2N | |
| B. | 阿替洛尔分子中含有2个手性碳原子 | |
| C. | 一定条件下,化合物甲与NaOH溶液、浓溴水、H2均可以发生反应 | |
| D. | 阿替洛尔在NaOH乙醇溶液中加热可发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 实验目的或结论 |
| A | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性:H2O2比Fe3+强 |
| B | 向1mL 1%的NaOH溶液中加入2mL 2%的CuSO4溶液,振荡,再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | 说明Y中不含醛基 |
| C | 取a g铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为V L(已转化为标准状况下) | 测定铝箔中氧化铝的含量 |
| D | 比较不同反应的反应热数据大小 | 从而判断反应速率的大小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| B | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 | 溶液中一定含有CO32- |
| C | 向某无色溶液中逐滴加入浓NaOH溶液,逐渐产生白色沉淀,然后沉淀逐渐消失 | 该溶液中一定含有Al3+ |
| D | 向某溶液中加入氯化银溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com